题目内容
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
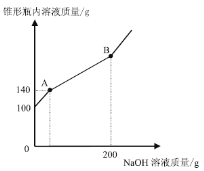
(l)反应至A点时加入氢氧化钠溶液的质量为__________;
(2)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为多少?(计算结果保留至0.1%)
【答案】(1)40g(1分);(2)10.4%
【解析】向盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,氢氧化钠先与盐酸反应生成氯化钠和水,后剩余的氢氧化钠再与氯化铜反应生成氢氧化铜沉淀和氯化钠;据质量守恒定律可知反应前后物质的总质量不变,所以(l)反应至A点时加入氢氧化钠溶液的质量为40g;设反应至B点时生成沉淀的质量为x,
CuCl2+2NaOH==2NaCl+Cu(OH)2↓
80 98
160g×10% x
80/160g×10%=98/x x=19.6g
反应至B点时锥形瓶内所得溶液的质量为:200g+100g-19.6g=280.4g;
生成氯化钠的总质量为:200g×10%×![]() /
/![]() =29.25g
=29.25g
反应至B点时锥形瓶内所得溶液的溶质质量分数29.25g÷280.4g×100%≈10.4%
答:略

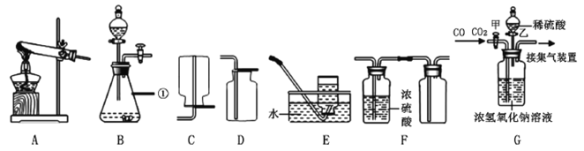
【题目】某同学进行下图两个实验。
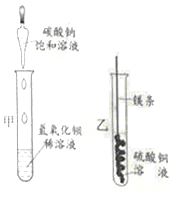
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。