题目内容
【题目】水是生命之源,没有水就没有生命。
(1) 从物质的分类角度分析,水不属于___(填字母)
A.单质 B.氧化物 C.化合物 D.纯净物
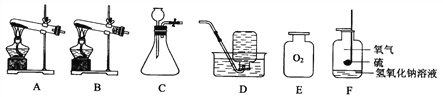
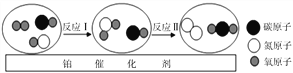
(2) 下图为电解水的实验,a试管中收集到的气体为____________,此反应的符号表达式(能写化学方程式最好)____________,此实验可以说明水是由________________________________组成的;从能量转化角度分析,电解水是将_______能转化为______________能。
(3)自来水厂净水过程的主要操作流程如下图:

【资料:常用的絮凝剂有明矾[ KAl(SO4)2·12H2O ],消毒剂有液氯。】
回答下列问题:
①操作X的名称是___________。
②明矾的作用是____________________________;其原理是明矾与水反应生成氢氧化铝胶状物。
③液氯(化学式Cl2)杀菌消毒属于________变化(填“物理”或“化学”),液氯也会与水中杂质反应生成一些对人体有害的物质。因此,水煮沸后,仍需要打开壶盖继续加热一会儿。
④自来水厂的净水过程____________(填“能”或“不能”)将硬水软化成软水,
生活中将硬水软化的方法是________________。
(4)海水淡化可缓解淡水资源匮乏的问题。下图为太阳能海水淡化装置图。水变成水蒸气的过程中,不发生变化的是______(填字母序号)。
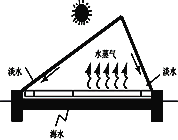
A.分子质量 B.分子运动 C.分子间隔 D.分子种类
这种方法与实验室通过_____(填操作名称)净化水的方法原理相同。
(5)下图净水器入水口在下方的优点是_____________。
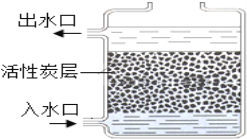
A.使水的化学性质发生改变 B.有助于除去悬浮性颗粒
C.不易堵塞活性炭孔 D.可以将硬水软化
(6)保护水环境,珍爱水资源,是每个公民应尽的责任和义务。为了防止水的污染,下列做法有利于保护水资源的是(填序号)______。
①抑制水中所有动、植物的生长; ②不任意排放工业废水;
③大量使用化肥农药; ④生活污水经过净化处理后再排放。
【答案】 A H2 略 氢元素和氧元素 电 化学 过滤 吸附杂质,使杂质沉淀 化学 不能 煮沸 A D 蒸馏 B C ②④
【解析】(1) 单质是由一种元素组成的纯净物,水由氢、氧两种元素组成的纯净物,不属于单质;(2) 电解水时正极生成的是氧气,负极生成的是氢气,氢气是氧气体积的2倍; a试管中收集到的气体为氢气,反应的化学方程式2H2O 通电 2H2↑+ O2↑,此实验可以说明水是由氢元素和氧元素组成的;从能量转化角度分析,电解水是将电能转化为化学能。(3)①操作X能将难溶性固体与液体分离,是过滤操作;②明矾在水中形成絮状物可加速悬浮颗粒沉降;③液氯(化学式Cl2)杀菌消毒,改变了物质的种类,属于化学;④自来水厂的净水过程不能除掉水中的可溶性钙镁化合物,不能将硬水软化成软水,煮沸可以将硬水中的钙镁化合物转化成沉淀而降低水的硬度。(4)水变成水蒸气的过程是物理变化,分子种类不变,所以分子的质量也不变;这种方法与实验室通过蒸馏净化水的方法原理相同。(5)水的入水口在下边,可以使水流动慢,有助于悬浮性颗粒沉降在下层水中,不易堵塞活性炭孔 ;(6) ①抑制水中所有动植物的生长,不能保持生态平衡,不能防止水污染,所以错误.②④不任意排放污水和对污水先处理再排放有利于保护水资源,正确。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】过碳酸钠(化学式为2Na2CO33H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是 。
A.鱼池供氧剂 B.消毒剂 C.干燥剂 D.漂白剂
(2)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中 有硅酸镁。(填写“可能”或“一定”)
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgN03溶液
实验操作 | 预期现象和必要结论 |
步骤:1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 |
|
步骤2:取少量步骤1所得的滤液于试管中,加入 ,振荡后静置。 | |
步骤3:取少量步骤2所得的溶液于试管中, 。 | ,说明样品中有MgSO4。 ,说明样品中没有MgSO4。 |
【题目】同学们应用数字化实验探究外界条件对双氧水分解速率的影响。实验装置如图:
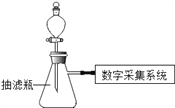
【进行实验】
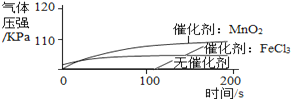
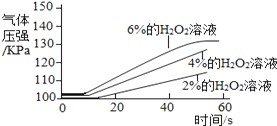
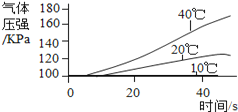
序号 | 主要实验步骤 | 装置内压强时间图象 |
实 验 1 | ①1号抽滤瓶中不加任何试剂, 2号抽滤瓶中加入0.2 g MnO2粉末, 3号抽滤瓶中加入0.2 g FeCl3粉末。 ②用三支分液漏斗分别加入15 mL 4%的H2O2溶液。 |
|
实 验 2 | ①三个抽滤瓶中分别加入0.2 gFeCl3粉末。 ②分别用1号分液漏斗加入15 mL2%的H2O2溶液;用2号分液漏斗加入15 mL4%的H2O2溶液;用3号分液漏斗加入15 mL6%的H2O2溶液。 |
|
实 验 3 | ①三个抽滤瓶中分别加入0.2 gFeCl3粉末,分别放入装有10℃、20℃、40℃水的水槽中。 ②用三支分液漏斗分别加入15 mL4%的H2O2溶液。 |
|
【解释与结论】
(1)某同学得到“不同催化剂的催化效果不同”的结论,他的依据是_________________________。
(2) 通过上述实验得到:影响该反应速率的外界因素有___________________________________。
【反思与评价】(3)经过多次实验,有的同学对比实验1的3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是___________________________________________。