题目内容
【题目】阅读下面科普短文(原文作者白玉敏、唐楠楠等,原文有删改)
豆腐是一种营养丰富、物美价廉、风味独特、历史悠久的中国传统大豆蛋白制品。
制作过程的操作如下:

“点浆”是制作豆腐过程中的关键环节。为什么凝固剂能使豆浆变成豆腐呢?这是因为豆浆中的蛋白质微粒能吸附带同种电荷的离子,使蛋白质微粒之间相互排斥,聚不到一块儿,凝固剂可“消除”所带电荷,使蛋白质微粒凝聚。
常用的凝固剂有盐卤、石膏和葡萄糖酸内酯。用盐卤(主要成分氯化镁)作凝固剂的豆腐风味独特,弹性好,但制作较难,产量低。用石膏(主要成分硫酸钙)作凝固剂的豆腐,产量较盐卤豆腐高,但豆腐中含未溶解的石膏小颗粒,使豆腐有涩味。用葡萄糖酸内酯(C6H10O6)作凝固剂的豆腐称为内酯豆腐,这种豆腐品质较好,保存时间长,但质地偏软,不适合煎炒。与传统盐卤豆腐和石膏豆腐相比,内酯豆腐可更好地保留大豆中的大豆异黄酮。大豆异黄酮可有效地预防心血管病和老年性痴呆症。
人们为了提高大豆中蛋白质的利用率,不断优化传统的生产工艺。近年来,研究人员研制了“全营养豆腐”制作的新工艺。豆腐中的营养成分、出品率、蛋白质利用率等都是评价豆腐生产工艺的重要指标。其中出品率是指豆腐的质量与原料大豆质量的百分比。蛋白质利用率的计算公式是:

研究人员以东北大豆为原料,通过大量实验寻找“全营养豆腐”最佳生产条件。下图表示在其他条件相同时,“全营养豆腐”的出品率与蛋白质含量随“点浆”温度的变化关系。下表是在最佳生产条件下,“全营养豆腐”和普通豆腐的品质对比。


指标测定(%) | 普通豆腐 | 全营养豆腐 |
出品率 | 202 | 422 |
蛋白质含量 | 6.52 | 6.41 |
蛋白质利用率 | 36.35 | 74.66 |
水分 | 86 | 86 |
脂肪 | 2.593 | 2.927 |
粗纤维 | 0.21 | 0.63 |
依据文章内容,回答下列问题:
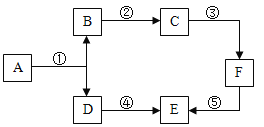
(1)豆腐制作过程中,利用过滤原理的操作是_____。
(2)“点浆”的原理是_____。
(3)依据上图,可得出“全营养豆腐”的最佳“点浆”温度为80℃,其原因是_____。
(4)对比上表数据,结合蛋白质利用率的计算公式,说明“全营养豆腐”制作工艺能提高蛋白质利用率的原因是_____。
(5)下列关于豆腐的说法正确的是_____(填序号)。
<>A 豆腐是人们饮食中蛋白质的来源之一B 内酯豆腐中大豆异黄酮的含量高于盐卤豆腐
C “全营养豆腐”比普通豆腐粗纤维含量高
D 为营养均衡,食用豆腐时尽量搭配蔬菜
【答案】过筛和压制 凝固剂可“消除”蛋白质所带的电荷,使蛋白质微粒凝聚 该温度下出品率和蛋白质的含量都高 两种豆腐所用原料大豆中蛋白质百分含量相同,豆腐样品中蛋白质含量差距不大,“全营养豆腐”出品率高则蛋白质利用率高 ABCD
【解析】
(1)过滤原理是将固体和液体进行分离,豆腐制作过程中,利用过滤原理的操作是过筛和压制,过筛后得到豆渣固体和豆浆液体,压制(用布包住点浆后的块装物,其中含水分)后得到豆腐和泔水。故填:过筛和压制。
(2)根据文章描述可得“点浆”的原理是:利用凝固剂“消除”豆浆中的蛋白质微粒所带电荷,使蛋白质微粒凝聚。故填:利用凝固剂“消除”豆浆中的蛋白质微粒所带电荷,使蛋白质微粒凝聚。
(3)“全营养豆腐”的出品率与蛋白质含量随“点浆”温度的变化关系可得,80℃时,出品率和蛋白质的含量都高,所以是最佳点浆温度。故填:该温度下出品率和蛋白质的含量都高。
(4)蛋白质利用率的计算公式是:![]() ,研究人员以东北大豆为原料(原料相同,原料大豆中蛋白质的百分含量相同),表中数据显示两种豆腐样品中蛋白质含量相差不大,“全营养豆腐”出品率高则蛋白质利用率就高。故填:两种豆腐所用原料大豆中蛋白质百分含量相同,豆腐样品中蛋白质含量差距不大,“全营养豆腐”出品率高则蛋白质利用率高。
,研究人员以东北大豆为原料(原料相同,原料大豆中蛋白质的百分含量相同),表中数据显示两种豆腐样品中蛋白质含量相差不大,“全营养豆腐”出品率高则蛋白质利用率就高。故填:两种豆腐所用原料大豆中蛋白质百分含量相同,豆腐样品中蛋白质含量差距不大,“全营养豆腐”出品率高则蛋白质利用率高。
(5)A. 豆腐是人们饮食中蛋白质的来源之一。故A符合题意;
B. 与传统盐卤豆腐和石膏豆腐相比,内酯豆腐可更好地保留大豆中的大豆异黄酮,故内酯豆腐中大豆异黄酮的含量高于盐卤豆腐。故B符合题意;
C. 根据表中数据,“全营养豆腐”粗纤维含量为0.63,普通豆腐粗纤维含量为0.21,所以“全营养豆腐”比普通豆腐粗纤维含量高。故C符合题意;
D. 豆腐含有的营养价值蛋白质,为营养均衡,食用豆腐时尽量搭配蔬菜(含有维生素)。故D符合题意。
故填:ABCD。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】野外探险,可以利用供氧剂过氧化钠(Na2O2)与CO2反应制取O2, 化学反应方程式为:![]() 。
。
(1) Na2O2中O元素的化合价是_______________。
(2)某兴趣小组的同学查阅资料,了解到二氧化硫(SO2)性质与CO2类似,可以与水反应生成亚硫酸(H2SO3),也可以与生石灰反应生成亚硫酸钙(CaSO3),还可以与氢氧化钠反应生成亚硫酸钠(Na2SO3)。
(提出问题)二氧化硫(SO2)与过氧化钠(Na2O2)反应,是否与CO2的完全一致?
(查阅资料)
I.少量二氧化硫(SO2)通入澄清石灰水中,也可以看到溶液变为混浊。写出溶液变为浑浊所发生的化学反应方程式_______________。
Ⅱ.亚硫酸钠(Na2SO3)固体和盐酸反 应会放出二氧化硫(SO2);
Ⅲ.亚硫酸钡(BaSO3)固体不溶于水,但可溶于盐酸放出二氧化硫(SO2)。
(提出猜想)二氧化硫(SO2)与过氧化钠(Na2O2)反应,若过氧化钠(Na2O2)完全反应,生成的固体产物;
猜想一:可能只有Na2SO3;
猜想二:可能只有Na2SO4;
猜想三:可能___________________
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
①取少量固体产物于烧杯,加入蒸馏水,搅拌溶解。 | 固体完全溶解。 | 钠盐均可溶于水。 |
②取少量①中所得溶液于试管,加入盐酸溶液。 | 有气体放出。 | 说明猜想_________(填“一”或“二”或“三”)是错误的。 |
③另取少量①中所得溶液于试管,加入适量BaCl2溶液, 过滤。 | 有沉淀生成。 | 生成的沉淀可能是__________(填化学式)。 |
④取③中得沉淀,加入足量的_________溶液。 | 有气体放出,沉淀部分溶解。 | 说明猜想三成立。 |
(实验结论)
猜想三成立。请写出④中放出气体所发生的化学反应方程式_______________。
(交流讨论)实验结束后,同学们一起讨论, 二氧化硫(SO2)与过氧化钠(Na2O2)反应生成硫酸钠是什么原理?他们带着这个问题去请教老师:老师告诉他们,二氧化硫(SO2)与过氧化钠(Na2O2)反应生成硫酸钠,是氧化还原反应。在氧化还原反应中,有元素化合价升高,必定有元素化合价降低。硫酸钠的生成,有两种可能:
a.生成的亚硫酸钠(Na2SO3)被O2氧化所得,发生的化学反应方程式为_______________。
b.过氧化钠(Na2O2)直接将二氧化硫(SO2)氧化所得。