题目内容
泰州市2013年中考化学实验考查有:①氧气的制取;②二氧化碳的制取;③配制50g 5%的NaCl溶液……等六个考签,由学生抽签确定一个考题进行考查。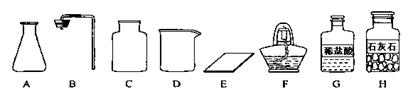
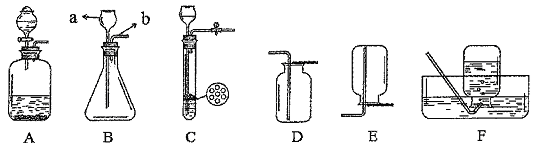
(1)甲同学抽签后来到实验室,发现本组实验桌上主要准备了下列仪器和药品:
①上图中仪器A的名称是 。
②甲同学抽到的考签应该是 (填字母代号)。
A.氧气的制取 B.二氧化碳的制取
③制取该气体的反应原理为 (用化学方程式表示)。制取一瓶该气体,应选用的仪器有 (填字母代号)。
④甲同学实验的主要步骤示意如下,请你帮他补充完整。组合装置→ →加入药品→收集气体。
⑤利用上述气体发生装置还可以制取其它气体,请写出其中一种反应的化学方程式 。
(2)乙同学在完成“配制50g 5%的NaCl溶液”实验过程中,通过计算需量取水约 mL,若量取水时俯视读数,则所配得溶液的溶质质量分数会 (填“偏大”、“偏小”或“无影响”)。溶解NaCl时用到的玻璃棒的作用是 。
(1)① 锥形瓶。② B ③ CaCO3+2HCl=CaCl2+H2O+CO2↑。ABCE 。④ 检查装置气密性。⑤ 2H2O2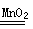 2H2O+ O2↑或Zn + H2SO4 = ZnSO4 + H2↑ (只要合理即给分)。(2)47.5 ,偏大。搅拌,加快NaCl的溶解速度 。
2H2O+ O2↑或Zn + H2SO4 = ZnSO4 + H2↑ (只要合理即给分)。(2)47.5 ,偏大。搅拌,加快NaCl的溶解速度 。
解析试题分析:(1)①上图中仪器A的名称是锥形瓶;依据药品及仪器可知到的考签应该是B二氧化碳的制取;③制取该气体的反应原理为CaCO3+2HCl=CaCl2+H2O+CO2↑;应选用的组装固液常温下反应的装置,故仪器有ABCE④甲同学实验的主要步骤示意如下,请你帮他补充完整。组合装置→检验装置的气密性→加入药品→收集气体;⑤利用上述气体发生装置还可以制取其它气体,其中生成另一种反应的化学方程式为Zn + H2SO4 = ZnSO4 + H2↑;(2)乙同学在完成“配制50g 5%的NaCl溶液”实验过程中,通过计算需量取水约50g-50g×5%=47.5g;47.5g/1g/Ml=47.5Ml若量取水时俯视读数,所量取的水的体积偏小,则所配得溶液的溶质质量分数会变大;溶解NaCl时用到的玻璃棒的作用是搅拌,加快NaCl的溶解速度
考点:实验室制取气体的思路和方法、及配制溶液

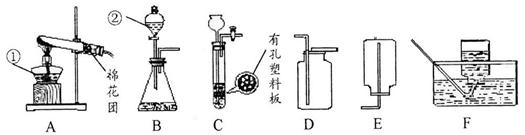
如图是实验室常用的气体制备、收集的多种功能装置。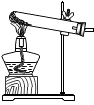
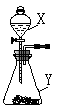
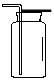
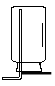
A B C D E F
(1)若实验室用A装置加热氯酸钾和二氧化锰混合物制取氧气,其化学方程式为 。
(2)若B装置X中盛放稀盐酸、Y中盛放石灰石,B与C组成发生、收集CO2气体的系列装置,检验CO2收满的方法是 ,检验制得气体是否为二氧化碳的化学方程式为 。
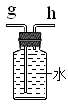
(3)若实验室用锌粒和稀硫酸制取氢气,可选择的发生装置为 ,反应的化学方程式为 。若用排水法收集并测定氢气的体积,氢气从E装置导管口 (填“g”或“h”) 进。选用仪器F测量排出水的体积,仪器F的名称是 。
(4)对锌与稀硫酸反应快慢的影响因素进行探究。反应过程中,利用前10min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下:
| 实验编号 | 试剂 | 前 10 min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和溶质质量分数的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
Ⅰ. 比较实验a和实验b,可以得到的结论是 。
Ⅱ.要比较不同溶质质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
Ⅲ. 控制其他条件相同,还需考虑控制的条件是 (例举一种条件即可)。
相关资料:
(一)盐酸是一种挥发性的酸,它会发出的氯化氢气体是一种易溶于水的气体.氯化氢溶于水既得盐酸;盐酸的挥发性随其溶质的质量分数减小而减弱.盐酸和醋酸一样能使紫色的石蕊试液变成红色.
(二)硫酸钙微溶于水.石灰石与稀硫酸反应,生成的硫酸钙会覆盖在石灰石表面,阻碍反应的继续发生.
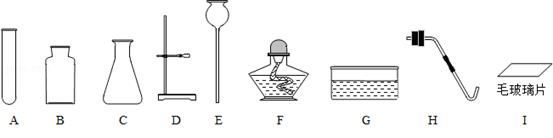
请你和小明仪器进行实验室制取二氧化碳的探究.
(1)选择药品.小明对三组药品进行了实验研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钙粉末和稀盐酸 | 产生气泡速率很快 |
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的化学方程式为 _________ ;不选择第③组药品的原因是 _________ .
(2)选择装置.通过对制取氧气装置的分析,他选择用过氧化氢制取氧气的发生装置.你认为他选择的依据是 _________ .
(3)制取气体.将药品装入所选装置制取气体,并用向上排空气法收集.验满方法是 _________ .
(4)气体检验.将生成的气体通入石蕊溶液中,溶液变红,因此他确定该气体是二氧化碳.他的检验方法是否正确?请说明理由. _________ .

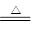 NH3↑+HCl↑
NH3↑+HCl↑