题目内容
长久使用的热水瓶底部有一层水垢.为了除去热水瓶底部的水垢,研究性学习小组的同学进行了下列研究和实验:
【查阅资料】水垢的主要成分是CaCO3和Mg(OH)2;Mg(OH)2与盐酸反应化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O.
【实验】取50g水垢的样品(杂质不与盐酸和水反应)放入烧杯中,加入足量的质量分数为10%盐酸,使样品完全反应,并记录反应过程中混合物质量的变化.烧杯及样品和稀盐酸的质量(m)起始时为300g.实验数据记录如下:
| 反应时间(min) | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| m(g) | 294.5 | 290.0 | 286.0 | 286.0 | 283.0 | 282.4 | 282.4 | 282.4 |
(1)分析表中记录的数据,你认为反应时间为________min时记录的质量数据是错误的.
(2)Mg(OH)2中镁、氧、氢三种元素的质量比为________.
(3)反应后的混合物中含有CaCl2和MgCl2.9.5g MgCl2含有的氯元素的质量与________g HCl含有的氯元素的质量相当.
(4)水垢中碳酸钙的质量分数是多少?
解:(1)碳酸钙与稀盐酸反应产生二氧化碳气体从烧杯中逸出,从而造成烧杯及样品和稀盐酸的质量减少,氢氧化镁与稀盐酸反应不产生气体,不会造成烧杯及样品和稀盐酸的质量减少.由表中数据可知:8min时和6min时烧杯及样品和稀盐酸的质量相等,均为286.0g,比10min时的质量283.0g大,说明8~10min时碳酸钙与稀盐酸的反应仍在进行;而8min与6min时烧杯及样品和稀盐酸的质量相等,说明6~8min时碳酸钙与稀盐酸的反应已经完成.这显然这是不可能的,不可能前边反应完成,后边反应又会进行.只能说明8min时记录的数据是错误的.
(2)氢氧化镁中镁、氧、氢三元素的质量比为24:(16×2):(1×2)=12:16:1
(3)HCl的质量为9.5g× ÷
÷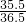 =7.3g
=7.3g
(4)设50g水垢中含CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100-------------------44
x--------------------17.6g
 =
= ,
,
x=40g
水垢中碳酸钙的质量分数为 ×100%=80%
×100%=80%
答:水垢中碳酸钙的质量分数为80%.
故答案为:(1)8;(2)12:16:1;(3)7.3;(4)水垢中碳酸钙的质量分数为80%.
分析:(1)由于碳酸钙与稀盐酸反应能产生二氧化碳气体并从烧杯中逸出,从而造成烧杯及样品和稀盐酸的质量减少,氢氧化镁与稀盐酸反应不产生气体,不会造成烧杯及样品和稀盐酸的质量减少.只要有碳酸钙和稀盐酸存在并接触,二者就会一直反应,直到其中一种物质完全反应为止.由表中时间和质量数据的变化情况,可以确定出错误的质量数据.
(2)化学式中各元素的质量比是元素的相对原子质量与原子个数乘积之比.
(3)物质中元素的质量等于物质的质量与该物质中该元素的质量分数,根据这一计算关系可以计算出HCl的质量.
(4)烧杯及样品和稀盐酸减少的总质量就是生成二氧化碳的质量,这一质量可以通过表中数据计算出来,通过这一质量,再根据碳酸钙与稀盐酸反应的化学方程式就能计算出水垢中碳酸钙的质量,最后计算出碳酸钙与水垢质量的百分比,即为水垢中碳酸钙的质量分数.
点评:本题主要考查化学反应的连续性、有关化学式的计算、质量分数的计算和有关化学方程式的计算.
只要反应物能够接触,反应就会一直进行下去,不会停止,直到一种物质或全部反应物完全反应时为止,中间不会间断.
进行元素质量比的计算时,相对原子质量与原子个数必须要对应、并相乘、再相比.
(2)氢氧化镁中镁、氧、氢三元素的质量比为24:(16×2):(1×2)=12:16:1
(3)HCl的质量为9.5g×
 ÷
÷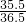 =7.3g
=7.3g(4)设50g水垢中含CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100-------------------44
x--------------------17.6g
 =
= ,
,x=40g
水垢中碳酸钙的质量分数为
 ×100%=80%
×100%=80%答:水垢中碳酸钙的质量分数为80%.
故答案为:(1)8;(2)12:16:1;(3)7.3;(4)水垢中碳酸钙的质量分数为80%.
分析:(1)由于碳酸钙与稀盐酸反应能产生二氧化碳气体并从烧杯中逸出,从而造成烧杯及样品和稀盐酸的质量减少,氢氧化镁与稀盐酸反应不产生气体,不会造成烧杯及样品和稀盐酸的质量减少.只要有碳酸钙和稀盐酸存在并接触,二者就会一直反应,直到其中一种物质完全反应为止.由表中时间和质量数据的变化情况,可以确定出错误的质量数据.
(2)化学式中各元素的质量比是元素的相对原子质量与原子个数乘积之比.
(3)物质中元素的质量等于物质的质量与该物质中该元素的质量分数,根据这一计算关系可以计算出HCl的质量.
(4)烧杯及样品和稀盐酸减少的总质量就是生成二氧化碳的质量,这一质量可以通过表中数据计算出来,通过这一质量,再根据碳酸钙与稀盐酸反应的化学方程式就能计算出水垢中碳酸钙的质量,最后计算出碳酸钙与水垢质量的百分比,即为水垢中碳酸钙的质量分数.
点评:本题主要考查化学反应的连续性、有关化学式的计算、质量分数的计算和有关化学方程式的计算.
只要反应物能够接触,反应就会一直进行下去,不会停止,直到一种物质或全部反应物完全反应时为止,中间不会间断.
进行元素质量比的计算时,相对原子质量与原子个数必须要对应、并相乘、再相比.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量.结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3 (填已或未)反应完全?
(2)当反应完全时,CaCO3消耗的氯化氢为 g.
(3)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3
(2)当反应完全时,CaCO3消耗的氯化氢为
(3)该水垢中CaCO3的质量分数是多少?
长久使用的热水瓶底部有一层水垢,主要成分是碳酸钙,用稀盐酸可以清除水垢.某学校化学课外兴趣小组的同学通过实验测定水垢中碳酸钙的含量,将过量的稀盐酸加到200g水垢中,同时测量4分钟内产生CO2的质量部分结果如下表:[CaCO3+2HCl═CaCl2+H2O+CO2↑]
(1)该小组因故没有记录反应时间为180s时的数
据M.你由表中数据推测,M= g.
(2)反应生成CO2的总质量为 g.(3)根据实验数据,在右边的坐标纸上绘制生成CO2质量与反应时间关系的曲线.你由曲线中推测在反应60s时,生成CO2的质量约为 .
(4)计算水垢中碳酸钙质量分数是多少?
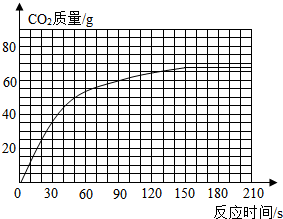
| 时间/s | 30 | 50 | 90 | 150 | 180 | 210 |
| CO2质量/g | 30 | 50 | 60 | 66 | M | 66 |
据M.你由表中数据推测,M=
(2)反应生成CO2的总质量为
(4)计算水垢中碳酸钙质量分数是多少?

长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量,结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3 (填已或未)反应完全?
(2)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3
(2)该水垢中CaCO3的质量分数是多少?
 CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质: