题目内容
【题目】现有10%的Na2CO3溶液,请按下面要求计算:
(1)106 g上述溶液中所含溶质的质量 g。
(2)106 g上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?
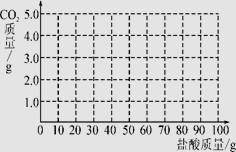
(3)向106 g上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为Na2CO3+HCl===NaHCO3+NaCl;当Na2CO3全部转化为NaHCO3后,再加入盐酸才开始放出CO2。请在图中画出产生气体的曲线。
(4)另取10%的Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:
物质 | Na2CO3 | HCl | X | NaCl | CO2 | H2O |
质量/g | 31.8 | 14.6 | 16.8 | 23.4 | 4.4 | w |
则w= ,
写出该反应的化学方程式 。
【答案】(1)10.6; (2)4.4 g;(3)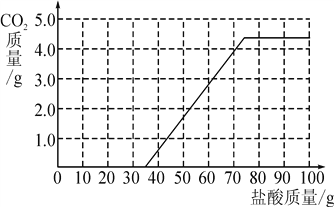 ;(4)1.8;3Na2CO3+4HCl===2NaHCO3+4NaCl+CO2↑+H2O
;(4)1.8;3Na2CO3+4HCl===2NaHCO3+4NaCl+CO2↑+H2O
【解析】(1) ![]() ,106 g上述溶液中所含溶质的质量:106g×10%=10.6g;
,106 g上述溶液中所含溶质的质量:106g×10%=10.6g;
(2)设10.6g碳酸钠与盐酸反应生成二氧化碳的质量为x,
Na2CO3+2HCl====2NaCl+H2O+CO2↑
106 44
10.6g x
106/10.6g=44/x x=4.4g
(3)设10.6g碳酸钠转化成碳酸氢钠反应的氯化氢质量为y
Na2CO3+HCl===NaHCO3+NaCl
106 36.5
10.6g y
y =3.65g
需要盐酸的质量为3.65g÷10%=36.5g
所以滴加盐酸的过程中反应生成气体的曲线图为

(4)据质量守恒定律可知反应前后物质的总质量不变,所以水的质量为31.8+14.6 -16.8-23.4-4.4=1.8g。由反应表中数据和质量守恒定律可知反应后生成碳酸氢钠;碳酸钠、氯化氢、碳酸氢钠、氯化钠、二氧化碳、水的分子个数比为:
![]() ,所以反应方程式为:3Na2CO3+4HCl===2NaHCO3+4NaCl+CO2↑+H2O
,所以反应方程式为:3Na2CO3+4HCl===2NaHCO3+4NaCl+CO2↑+H2O

 名校课堂系列答案
名校课堂系列答案