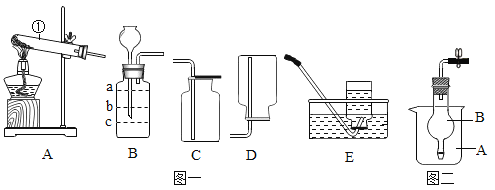
题目内容
【题目】下列实验不能达到实验目的是( )
A.  鉴别硬水和软水
鉴别硬水和软水
B. 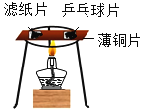 探究燃烧条件之一:达到燃烧所需最低温度
探究燃烧条件之一:达到燃烧所需最低温度
C. 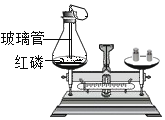 探究质量守恒定律
探究质量守恒定律
D. 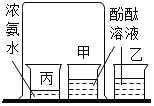 探究分子的运动与温度的关系
探究分子的运动与温度的关系
【答案】D
【解析】
A、硬水和软水的区别在于所含的钙镁离子的多少,可用肥皂水来区分硬水和软水,加入肥皂水,若产生泡沫较多,则是软水,若产生泡沫较少,则是硬水,故选项实验能达到实验目的;
B、实验过程中乒乓球碎片先燃烧,滤纸碎片后燃烧,说明燃烧的条件之一是温度达到可燃物的着火点,故选项实验能达到实验目的;
C、红磷在空气中燃烧生成五氧化二磷,没有物质逸出,反应前后容器中物质的总质量不变,能直接用于验证质量守恒定律,故选项实验能达到实验目的;
D、一段时间后甲烧杯中的酚酞溶液变红色,而两者没有直接接触,说明氨分子运动到了酚酞溶液中,但不能说明分子的运动与温度的关系,故选项实验不能达到实验目的。
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】氧气是重要的资源,回答下列问题。
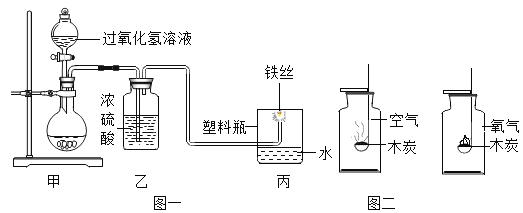
(1)图一为“铁丝在氧气中燃烧”的实验改进装置(浓硫酸具有吸水性,可干燥氧气)。图一甲装置:固体是二氧化锰,其作用是______________;发生反应的文字表达式为________;图一丙装置:铁丝在氧气中燃烧,观察到的实验现象_______________;用塑料瓶代替集气瓶的优点之一是_______。
(2)某兴趣小组为了研究用向上排空气法和排水法收集的氧气浓度是否有差异,做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,井使用传感器测定收集到的氧气浓度,数据见表。
收集方法 | 向上排空气法 | 排水集气法 | ||||
氧气浓度% | 79.6 | 79.7 | 79.9 | 90.0 | 89.8 | 89.3 |
氧气平均浓度% | 79.7 | 89.7 | ||||
①用向上排空气法收集氧气时,以能使放置在集气瓶瓶口的带火星木条复燃为氧气集满的标准;用排水集气法收集氧气时,以观察到____________为氧气集满的标准。
②以上两种方法中,用_________________法收集到的氧气更纯净。
③不考虑操作因素,排水集气法获得的氧气体积分数不能达到100%主要原因_____________。
④向上排空气法收集到的氧气浓度只有80%左右的原因有_________(填字母序号)。
A 氧气的密度略大于空气的密度
B 加热高锰酸钾固体产生氧气的浓度只有80%左右
C 当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
(3)分别把点燃的木炭放入装有空气和氧气的集气瓶中燃烧,如图二,对比木炭在空气和氧气中燃烧的现象,说明影响燃烧剧烈程度的一种因素是________________。
(4)在潜水艇中提供氧气的反应原理之一是:过氧化钠(固体)和水反应生成氢氧化钠和氧气,实验室中可用(如图三所示)_____ 装置来模拟其制取过程(填字母序号)。
【题目】化学使世界更美好,通过学习,我们有很多的收获。
收获一:世界万物都是由元素组成的,请用适当的化学符号填空:
①正三价的铝元素__________;
②硝酸钾中的原子团__________;
③人体中含量最多的物质:__________;
④植物光合作用的原料___________;
⑤海水中除了水之外,含量最丰富的物质是________。
收获二:我们学会了从宏观和微观的角度认识物质世界。
①在水、铜和氮气三种物质中,__________(填化学式)是由原子直接构成的;
②“O”和“●”表示不同元素的原子,以下图示表示单质的是__________(选填编号);
A 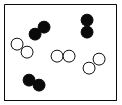 B
B 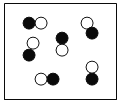 C
C 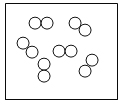 D
D 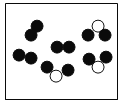
③食品中常加入防腐剂——苯甲酸钠![]() 。该防腐剂由_________;种元素组成,摩尔质量为__________;0.1mol的苯甲酸钠中约含有__________个氧原子。
。该防腐剂由_________;种元素组成,摩尔质量为__________;0.1mol的苯甲酸钠中约含有__________个氧原子。
收获三:生活中处处有化学,“家”就是一个化学小世界,蕴含丰富的化学知识。
①某矿泉水的主要矿物质成分及含量如下表:
成分 | Ca | K | Zn | F |
含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
这里Ca、K、Zn、F是指_________(选填“元素、原子、单质”)。
②下表为几种家用清洁剂的功能及有效成分:
名称 | 功能 | 有效成分 |
漂白精 | 快速漂除衣物污渍 | HC1 H2O |
洁厕灵 | 有效清除污垢与异味 | HC1 NaClO |
活氧彩漂 | 漂洗使衣物色彩鲜艳 | NaClO H 2O 2 |
I.这些清洁剂属于_________(选填“混合物”或“纯净物”),若不小心把“洁厕灵”打翻在大理石地面上,会出现__________的现象;
Ⅱ.![]() 中氢、氧元素质量比为________;
中氢、氧元素质量比为________;
Ⅲ.“洁厕灵”与“漂白精”不能混用,二者混合易产生一种有毒气体X。反应原理为: ![]() ,则X的化学式为________。
,则X的化学式为________。
③玻璃中的主要成分![]() 属于__________(选填“金属氧化物”或“非金属氧化物”)。
属于__________(选填“金属氧化物”或“非金属氧化物”)。
④塑料诞生一百年来风光无限,它的发明者贝克兰也因此荣获“塑料之父”的美誉,而今由于人们使用不当而直接引发的一大环境问题是________(选填编号)。
A 沙尘暴 B 水土流失 C 温室效应 D 白色污染
⑤天然气的主要成分是甲烷![]() ,一个甲烷分子的质量约为_______克(只列式,不用计算结果)。
,一个甲烷分子的质量约为_______克(只列式,不用计算结果)。
【题目】硫酸铜溶液能对过氧化氢的分解起催化作用.某小组拟在相同浓度硫酸铜溶液的催化下,探究硫酸铜对不同浓度过氧化氢溶液分解速率的影响.
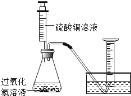
(1)分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的硫酸铜溶液,如图观察到产生气泡的速率不同,就可以粗略判断,得出实验结果.写出有关反应的化学方程式_____ ;
(2)为进一步判断上述实验结论的准确性,运用图,小刚同学进行了如下实验方案设计.
[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
[方案二]在不同过氧化氢浓度下,测定 ____________.
方案二的实验测量结果:
实验序号 物理量 | 过氧化氢溶液的浓度和体积 | 6%硫酸铜溶液的 体积(mL) | 反应的时间 (min) | 生成氧气的 体积(mL) |
1 | 8%10mL | x | 5 | V1 |
2 | 16%10mL | 3 | 5 | V2 |
表中x= _____.
实验结论:通过测量,若V1<V2,说明其它条件相同时, _________.
[继续探究]除了上述探究的影响反应速率的因素外,还有哪些因素可能会影响过氧化氢分解的反应速率?_______________(答一条即可)