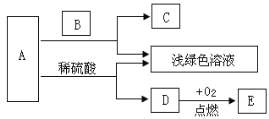
题目内容
【题目】小军同学在实验室帮老师整理药品时发现NaOH溶液试剂瓶口有一些白色固体,于是生好奇心:这白色固体是什么?他为此进行了如下探究
(查阅资料)①NaOH在空气中变质不会生成NaHCO3;
②CO2不溶解于饱和NaHCO3溶液中,也不与NaHCO3反应;
③Fe(OH)3呈红褐色,难溶于水;BaCl2溶液呈中性。
(提出猜想)猜想一:是NaOH
猜想二:是Na2CO3
猜想三:_____
(实验探究)小军进行了下列实验探究
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体于试管中,加水溶解,再加入足量BaCl2溶液 | _____ | 猜想二正确 |
②过滤,在滤液中加入FeCl3溶液 | 无红褐色沉淀生成 |
(问题分析)实验操作①中加入足量BaCl2溶液的作用是_____,实验操作②还有其他实验方案吗?如有,请写出一种实验方案(必须指明试剂和现象)_____。为了提高实验结论的准确性,小军又设计了如图所示的实验对该白色固体的性质进行进一步探究:
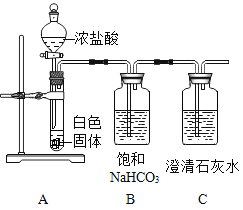
(实验现象)A中有大量气泡产生,C中实验现象是_____
(实验结论)白色固体是Na2CO3
(分析与反思)小军在与老师进行交流后得知,自己所设计的实验存在一定的缺陷,他对自己实验中存在的问题进行了反思:装置B中也能产生CO2。写出装置B中产生CO2的化学反应方程式_____。改进措施:_____。
【答案】是NaOH和Na2CO3混合物 产生白色沉淀 检验并且除去碳酸钠,防止它对氢氧化钠检验产生干扰 过滤,在滤液中滴加酚酞试液,溶液变红色,说明溶液中含有氢氧化钠 澄清石灰水变浑浊 NaHCO3+HCl═NaCl+H2O+CO2↑ 浓盐酸换为稀盐酸
【解析】
提出猜想:
猜想一:氢氧化钠没有变质:是NaOH 猜想二:氢氧化钠全部变质:是Na2CO3 猜想三:氢氧化钠部分变质:是NaOH、Na2CO3。
实验探究:
①取少量白色固体于试管中,加水溶解,再加入足量BaCl2溶液,产生白色沉淀,是因为氯化钡和碳酸钠反应生成了碳酸钡沉淀和氯化钠;
②对上述操作后的滤液进行过滤,在滤液中加入FeCl3溶液,无红褐色沉淀生成,说明溶液中不含有氢氧化钠。
猜想二正确。
问题
实验操作①中加入足量BaCl2溶液的作用是检验并且除去碳酸钠,防止它对氢氧化钠检验产生干扰;
实验操作②的主要目的是验证溶液中是否有氢氧化钠,可以通过验证溶液中是否存在氢氧根来验证。故有其他方案,如:过滤,在滤液中滴加酚酞试液,溶液变红色,说明溶液中含有氢氧化钠(合理即可)。
实验现象:
氯化氢和碳酸氢钠反应生成氯化钠、水和二氧化碳,A中有大量气泡产生,说明白色物质中含有碳酸钠。二氧化碳能使澄清石灰水变浑浊,所以C中的实验现象是澄清石灰水变浑浊。
分析与反思:
装置B中也能产生CO2,是因为浓盐酸具有挥发性,浓盐酸挥发出的氯化氢在装置B中和碳酸氢钠反应生成氯化钠、水和二氧化碳,反应的化学反应方程式:NaHCO3+HCl═NaCl+H2O+CO2↑。改进措施:将浓盐酸换为稀盐酸。

【题目】在饱和的碳酸钠溶液中通入CO2可用来制备碳酸氢钠(NaHCO3),发生反应的化学方程式为Na2CO3+CO2+H2O = 2NaHCO3。由于溶解度不同,饱和碳酸钠溶液中通入CO2会析出碳酸氢钠晶体而使溶液变浑浊。某化学课外小组同学发现不同条件下出现浑浊的时间不同。
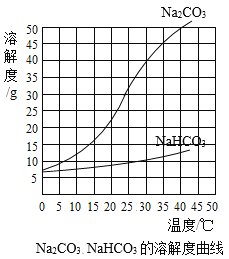
Na2CO3、NaHCO3的溶解度曲线
(提出问题)影响碳酸氢钠晶体产生速率的因素有哪些?
(猜想与假设)碳酸氢钠晶体产生速率的影响因素有温度、试管内径、CO2流速、饱和碳酸钠溶液的体积。
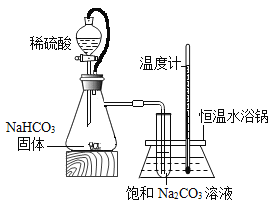
(进行实验)实验装置如下图所示。每次实验时均在试管里加入1mL饱和碳酸钠溶液并在试管后放置一张写有黑色字迹的白纸,从垂直于试管的方向观察白纸上字迹的清晰程度,记录时间,用于判断碳酸氢钠晶体的产生速率。部分实验记录如下表所示。
序号 | 温度 | 试管内径 | CO2流速 (个/秒) | 产生不同现象的时间 | ||
字迹变淡 | 字迹模糊 | 字迹消失 | ||||
① | 25 | 10 mm | 5-8 | 517" | 719" | 817" |
② | 32 | 10 mm | 5-8 | 350" | 409" | 428" |
③ | 40 | 10 mm | 5-8 | 348" | 406" | 418" |
④ | 25 | 14 mm | 5-8 | 636" | 738" | 828" |
⑤ | 25 | 25 mm | 5-8 | X | 943" | 1022" |
⑥ | 25 | 10 mm | 10-13 | 502" | 640" | 758" |
⑦ | 25 | 10 mm | 2-5 | 540" | 1045" | 1236" |
(解释与结论)
(1)由上述溶解度曲线图可获得的信息有________(写出一条即可)。
(2)锥形瓶中是利用碳酸氢钠与稀硫酸(H2SO4)反应来制二氧化碳。除生成二氧化碳外,还有水和硫酸钠(Na2SO4)生成,该反应的化学方程式为________。
(3)实验①④⑤研究的影响因素是________。
(4)表中X应该是________。
A 605" B 845" C 955"
(5)通过对数据的观察和分析,小明认为“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”,得到该结论的依据是________(填实验序号)。
(6)结合实验①②③,可得出的结论是_________。
(7)若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有________。