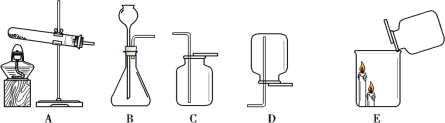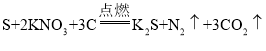题目内容
【题目】在饱和的碳酸钠溶液中通入CO2可用来制备碳酸氢钠(NaHCO3),发生反应的化学方程式为Na2CO3+CO2+H2O = 2NaHCO3。由于溶解度不同,饱和碳酸钠溶液中通入CO2会析出碳酸氢钠晶体而使溶液变浑浊。某化学课外小组同学发现不同条件下出现浑浊的时间不同。
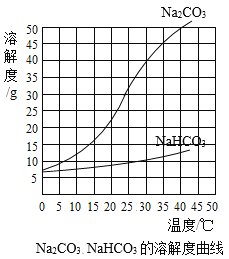
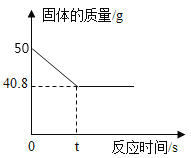
Na2CO3、NaHCO3的溶解度曲线
(提出问题)影响碳酸氢钠晶体产生速率的因素有哪些?
(猜想与假设)碳酸氢钠晶体产生速率的影响因素有温度、试管内径、CO2流速、饱和碳酸钠溶液的体积。
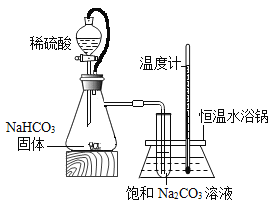
(进行实验)实验装置如下图所示。每次实验时均在试管里加入1mL饱和碳酸钠溶液并在试管后放置一张写有黑色字迹的白纸,从垂直于试管的方向观察白纸上字迹的清晰程度,记录时间,用于判断碳酸氢钠晶体的产生速率。部分实验记录如下表所示。
序号 | 温度 | 试管内径 | CO2流速 (个/秒) | 产生不同现象的时间 | ||
字迹变淡 | 字迹模糊 | 字迹消失 | ||||
① | 25 | 10 mm | 5-8 | 517" | 719" | 817" |
② | 32 | 10 mm | 5-8 | 350" | 409" | 428" |
③ | 40 | 10 mm | 5-8 | 348" | 406" | 418" |
④ | 25 | 14 mm | 5-8 | 636" | 738" | 828" |
⑤ | 25 | 25 mm | 5-8 | X | 943" | 1022" |
⑥ | 25 | 10 mm | 10-13 | 502" | 640" | 758" |
⑦ | 25 | 10 mm | 2-5 | 540" | 1045" | 1236" |
(解释与结论)
(1)由上述溶解度曲线图可获得的信息有________(写出一条即可)。
(2)锥形瓶中是利用碳酸氢钠与稀硫酸(H2SO4)反应来制二氧化碳。除生成二氧化碳外,还有水和硫酸钠(Na2SO4)生成,该反应的化学方程式为________。
(3)实验①④⑤研究的影响因素是________。
(4)表中X应该是________。
A 605" B 845" C 955"
(5)通过对数据的观察和分析,小明认为“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”,得到该结论的依据是________(填实验序号)。
(6)结合实验①②③,可得出的结论是_________。
(7)若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有________。
【答案】Na2CO3 的溶解度受温度影响变化较大 ![]() 试管内径 B ①⑥⑦ 其他条件不变时,温度越高,碳酸氢钠晶体产生速率越快 温度、试管内径、CO2流速
试管内径 B ①⑥⑦ 其他条件不变时,温度越高,碳酸氢钠晶体产生速率越快 温度、试管内径、CO2流速
【解析】
(1)根据溶解度曲线的信息来分析;
(2)根据反应的原理以及化学方程式的写法来分析解答;
(3)根据控制变量的原理来分析解答;
(4)根据表格中的数据进行分析;
(5)根据实验的数据进行分析对比解答;
(6)分析实验①②③中的变量与不变量进行解答;
(7)根据实验现象与表格中的数据来分析。
(1)由溶解度曲线可知,碳酸钠的溶解度受温度影响比较大,而碳酸氢钠的溶解度受温度影响比较小;
(2)碳酸氢钠与硫酸反应生成硫酸钠、水和二氧化碳;反应的化学方程式为![]() ;
;
(3)实验①④⑤中温度和二氧化碳流速相同,但是试管的内径不同,因为这三个实验探究的是试管内径对实验结果的影响;
(4)由表格中的数据以及信息可知,表中X应该介于636“~943“之间;故填:B;
(5)由实验①⑥⑦对比可知,在温度相同、试管内径相同的条件下,二氧化碳流速越快,碳酸氢钠晶体产生速率越快;故填:①⑥⑦;
(6)实验①②③中,试管内径和二氧化碳流速相同时,温度越高,碳酸氢钠晶体产生速率越快,即其他条件不变时,温度越高,碳酸氢钠晶体产生速率越快;
(7)由实验现象可知,温度、试管内径、CO2流速对碳酸氢钠晶体产生速率都有影响,因此若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,温度、试管内径、CO2流速三个变量都需要控制。