题目内容
【题目】某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出![]() 合金样品,将
合金样品,将![]() 稀硫酸分
稀硫酸分![]() 次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 剩余固体质量 |
第一次加入 |
第二次加入 |
第三次加入 |
第四次加入 |
第五次加入 |
第六次加入 |
(1)测定过程中发生反应的化学方程式为:________.
(2)从以上数据可知,最后剩余的![]() 固体的成分是________;这六次实验中,第________次加入稀硫酸时样品中的镁已经完全反应;表格中,
固体的成分是________;这六次实验中,第________次加入稀硫酸时样品中的镁已经完全反应;表格中,![]() ________.
________.
(3)计算合金样品中镁的质量分数________(只写答案,不需要写计算过程).
【答案】![]() 铜 5 2.5g
铜 5 2.5g ![]()
【解析】
(1)根据金属的活动性顺序,镁与硫酸反应生成硫酸镁和氢气,铜不反应;故答案为:Mg+H2SO4=MgSO4+H2↑
(2)因为铜不与硫酸反应,因此最后剩余的0.6g固体的成分是铜;从表格数据可知,每10g硫酸就消耗0.5g镁,因此m=3g-0.5g=2.5g,所以第五次加入稀硫酸时样品中的镁已经完全反应.故答案为:铜;5;2.5g
(3)镁的质量分数=![]() ×100%=80%
×100%=80%
故答案为:80%

练习册系列答案
相关题目
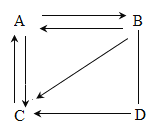
【题目】在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得部分数据如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 18 | 1 | 2 | 32 |
反应后质量/g | X | 26 | 2 | 12 |
下列说法中,正确的是( )
A.反应后物质甲的质量为13g
B.物质丙是该反应的催化剂
C.参加反应的甲和丁的质量之比为9:16
D.![]()