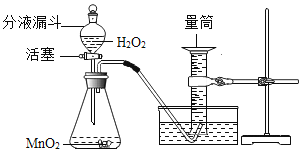
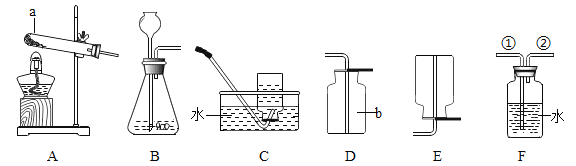
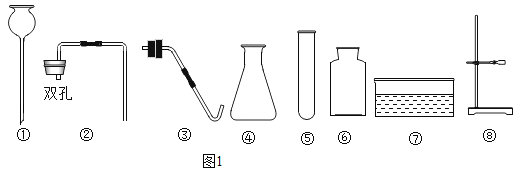
题目内容
【题目】元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息:
(1)硫原子结构示意图如图1,在化学反应中易________电子(选填“得到”或“失去”),形成_______(填粒子符号)。
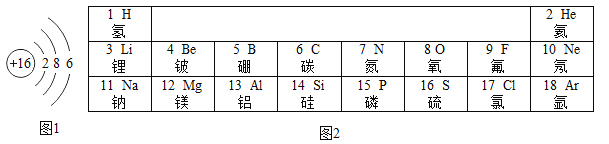
(2)地壳中含量位于前两位的元素组成的化合物是_____________(填化学式)。
(3)9号元素与17号元素化学性质相似的原因是___________。
(4)镁元素和铝元素都位于第三周期,下列有关说法正确的是__________(选填序号)。
a 镁和铝都属于非金属元素 b 镁原子和铝原子核电荷数相同
c 镁原子和铝原子质子数不同 d 镁原子和铝原子核外电子数不同
e 镁原子和铝原子电子层数相同f 镁原子和铝原子最外层电子数相同
(5)图3为某化学反应在催化剂的作用下的微观模拟示意图,其中实心黑球和阴影白球分别表示氧原子和氢原子。请画出方框内应填的微观图示。________

【答案】得到 S2- SiO2 最外层电子数相等 cde ![]()
【解析】
(1)根据硫原子结构示意图可知,硫原子最外层电子数为6,多于4个,在化学反应中易得到2个电子,形成S2-;
(2)地壳中含量位于前两位的元素分别为氧和硅,组成的化合物是二氧化硅,其化学式为SiO2;
(3)9号元素是氟元素,氟原子最外层电子数是7,17号元素是氯元素,氯原子最外层电子数是7,氟元素和氯元素化学性质相似的原因是最外层电子数相等;
(4)a 镁和铝都属于金属元素,故a错误;
b 镁原子和铝原子核电荷数分别为12和13,故b错误;
c 镁原子和铝原子核电荷数分别为12和13,故c正确;
d 镁原子和铝原子核外电子数分别为12和13,故d正确;
e 镁原子和铝原子电子层数相同,都是3,故e正确;
f 镁原子和铝原子最外层电子数分别为2和3,故f错误。故选cde。
(5)根据质量守恒定律,在化学反应中原子的种类和数目不变,方框内应填的微观粒子是1个氧分子,如图所示![]() 。
。

【题目】某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出![]() 合金样品,将
合金样品,将![]() 稀硫酸分
稀硫酸分![]() 次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 剩余固体质量 |
第一次加入 |
第二次加入 |
第三次加入 |
第四次加入 |
第五次加入 |
第六次加入 |
(1)测定过程中发生反应的化学方程式为:________.
(2)从以上数据可知,最后剩余的![]() 固体的成分是________;这六次实验中,第________次加入稀硫酸时样品中的镁已经完全反应;表格中,
固体的成分是________;这六次实验中,第________次加入稀硫酸时样品中的镁已经完全反应;表格中,![]() ________.
________.
(3)计算合金样品中镁的质量分数________(只写答案,不需要写计算过程).