题目内容
【题目】实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验。请根据实验回答:
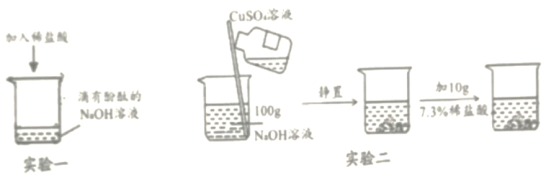
(1)甲同学进行了实验一,能观察到的明显现象是__________,同时测定反应后溶液的pH=2,说明酸能与碱发生化学反应。
(2)乙同学进行了实验二,当倒入CuSO4溶液观察到现象是_________,再加入稀盐酸,发现无明显变化,于是得出“酸不一定能与碱反应”的结论。丙同学对此产生质疑,用pH试纸测定实验二反应后混合物中上层清液pH=12,说明上层清液溶质中含有__________。你认为丙同学质疑乙同学结论的原因是________。
(3)丁同学利用上述实验后的废液继续实验。将实验二反应后的混合物过滤,得滤渣和滤液。将滤渣分为两等份,向一份滤渣中逐滴加入实验一所得溶液,能说明酸与碱发生化学反应的现象是________,反应的化学方程式是________,将另一份滤渣洗涤、晾干、称量,质量为0.98g.
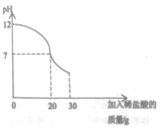
(4)戊同学向丁同学的滤液中继续逐滴滴加质量分数为7.3%的稀盐酸30g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。乙同学所用NaOH溶液溶质的质量分数为_________。
【答案】溶液红色褪去 生成蓝色(胶状)(或絮状)沉淀 NaOH(化学式或名称均给分,多写NaCl、Na2SO4也给分) 氢氧化钠过量,盐酸不足,盐酸与氢氧化钠先反应(合理即给分) 固体溶解,溶液变蓝 ![]() 4%
4%
【解析】
(1)碱性溶液使无色酚酞变红,无色酚酞在中性、酸性溶液中显无色,甲同学进行了实验一,能观察到的明显现象是溶液红色褪去,同时测定反应后溶液的pH=2,说明酸能与碱发生化学反应。
(2)乙同学进行了实验二,当倒入CuSO4溶液后,硫酸铜与氢氧化钠反应生成氢氧化铜蓝色蓝色(胶状)(或絮状)沉淀和硫酸钠,观察到现象是生成蓝色(胶状)(或絮状)沉淀,用pH试纸测定实验二反应后混合物中上层清液pH=12,为碱性,说明上层清液溶质中含有 NaOH。丙同学质疑乙同学结论的原因是氢氧化钠过量,盐酸不足,盐酸与氢氧化钠先反应(合理即给分)。
(3)丁同学利用上述实验后的废液继续实验。将实验二反应后的混合物过滤,得滤渣和滤液。将滤渣分为两等份,向一份滤渣中逐滴加入实验一所得溶液,能说明酸与碱发生化学反应的现象是固体溶解,溶液变蓝,氢氧化铜与稀盐酸反应生成氯化铜和水,反应的化学方程式是![]() 。
。
(4)根据“将另一份滤渣洗涤、晾干、称量,质量为0.98g”,可知硫酸铜与氢氧化钠反应生成氢氧化铜沉淀的总质量为0.98g+0.98g=1.96g;丁同学的滤液中滴加质量分数为7.3%的稀盐酸20g时,溶液显中性,又实验二中加入质量分数为7.3%的稀盐酸10g,故与氢氧化钠反应消耗的稀盐酸质量为20g+10g=30g;设与硫酸铜反应的氢氧化钠质量为x,与稀盐酸反应的氢氧化钠质量为y,则
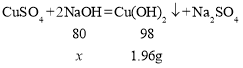
![]()
x=1.6g;
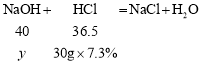
![]()
y=2.4g;
乙同学所用NaOH溶液溶质的质量分数为![]() 。
。

 励耘书业暑假衔接宁波出版社系列答案
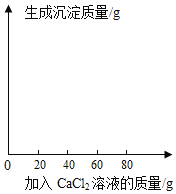
励耘书业暑假衔接宁波出版社系列答案【题目】某食用碱的主要成分是Na2CO3,其中含有少量的NaCl,小明同学为测定该食用碱中Na2CO3的质量分数,他进行了以下实验,取40 g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱溶液的质量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液的质量 | 20g | 40g | 60g | 80g |
生成沉淀的质量 | 2.5g | 5g | m | 8g |
请分析表中数据并计算回答。
(1)m=________;
(2)40 g该食用碱配成的溶液与足量CaCl2溶液反应,最多生成沉淀质量为多少;
(3)该食用碱中Na2CO3的质量分数是?(写出计算过程,答案精确到0.1%)
(4)请根据实验四的数据画图并标上合适的坐标。