题目内容
【题目】老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种。同学们对该粉末进行了定性与定量研究。
(1)定性实验:
实验方案 | 实验现象 | 实验结论 |
取少量红色粉末放入试管 中,滴加足量的稀盐酸振荡 | 红色粉末全部消失,溶液呈棕黄色 | 粉末为Fe2O3 |
_____ | 粉末Cu |
写出“红色粉末全部消失”发生反应的化学方程式_____。
(2)定量实验:
取该粉末4g放入硬质玻璃管中,先通CO,然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
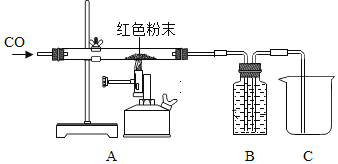
①实验时,先通CO再加热的目的是_____。
②若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是_____。B装置是用于吸收二氧化碳并收集CO,其中盛放的试剂最好是_____。
A NaOH溶液 B 稀盐酸 C 水
如果该实验没有装置B、C,实验造成的危害是_____。
③若该粉末为铜粉和氧化铁的混合物,待装置完全冷却至室温,称量硬质玻璃管内剩余固体的质量为mg。则m的取值范围是_____。
【答案】无明显现象 Fe2O3+6HCl=2FeCl3+3H2O 防止一氧化碳和装置内的空气形成混合气体,加热时发生爆炸 红色物质变成黑色 A 未反应的一氧化碳进入空气污染环境 2.8g<m<4g
【解析】
(1)因为在金属活动顺序中铜在氢的后面,铜不和稀盐酸反应,如果红色粉末是铜,则取少量红色粉末放入试管中,滴加足量的稀盐酸振荡则无明显现象;
氧化铁和盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl=FeCl3+3H2O;
(2)①为了防止一氧化碳和装置内的空气形成混合气体在加热时发生爆炸,所以先通一会一氧化碳再加热;
②若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是红色物质变成黑色;B装置是用于吸收二氧化碳并收集CO,其中盛放的试剂最好是氢氧化钠溶液;
一氧化碳有毒,不能直接排放到空气中污染环境;
③假设4g全部都是氧化铁,设4g氧化铁完全反应生成铁的质量为x
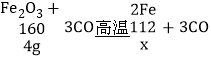
![]() x=2.8g
x=2.8g
因为该粉末为铜粉和氧化铁的混合物,则m的取值范围是2.8g<m<4g。
故答案为:
(1)无明显现象;Fe2O3+6HCl=2FeCl3+3H2O;
(2)①防止一氧化碳和装置内的空气形成混合气体,加热时发生爆炸;
②红色物质变成黑色;A;未反应的一氧化碳进入空气污染环境;
③ 2.8g<m<4g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在宏观、微观和符号之间建立联系是化学学科学习的特点。甲、乙、丙、丁表示四种物质,它们的微观示意图如表所示
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
|
(1)一个丙分子共有_____个原子。
(2)甲、乙两种物质在一定条件下反应生成丙和丁,反应的化学方程式为_____参加反应的甲和乙的分子个数比为_____。