题目内容
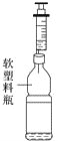
【题目】某化学探究小组利用如图所示装置来验证水的组成。

(实验步骤)
①用大注射器抽取一定量的2%的硫酸溶液,从A中的大圆孔注入;②用两个橡胶帽塞住右边两个出气口,用带针头的小注射器分别在出气口1和2处抽气液面上升,直至水充满正负两极;③接通电源,待C中气体体积达到最大刻度时,关闭电源;仔细观察实验装置中的现象;④分别用带针头的注射器抽取气体并检验。
(交流与反思)
(1)步骤①,在水中加入硫酸的作用是_____。
(2)步骤②的目的是_____。
(3)步骤③中的现象有:两极上均有气泡冒出_____。
(4)步骤④中检验C中生成气体的方法是_____。
【答案】增强水的导电性 排尽B、C中的空气; 两电极上产生的气体体积比为2:1;A中液面上升 点燃注射器中的气体,观察是否发出淡蓝色的火焰
【解析】
(1)在进行电解水实验时,往往要在水中加入硫酸,作用是增强水的导电性;
(2)用两个橡胶帽塞住右边两个出气口,用带针头的小注射器分别在出气口1和2处抽气,液面上升,直至水充满正负两极,目的是排尽B、C中的空气,若不小心抽到了液体,最好的做法是注入A中;
(3)步骤③中的现象有:两极上均有气泡冒出,两电极上产生的气体体积比为2:1,A中液面上升;
(4)由图中可知,C与电源得的负极相连,产生的气体是氢气,步骤④中检验C中生成气体的方法是点燃注射器中的气体。
故答案为:
(1)增强水的导电性;(2)排尽B、C中的空气;(3)两电极上产生的气体体积比为2:1;A中液面上升;(4)点燃注射器中的气体,观察是否发出淡蓝色的火焰。

 开心蛙状元测试卷系列答案
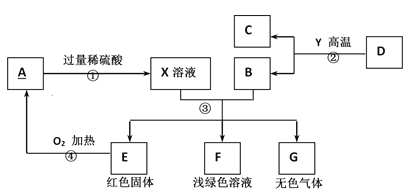
开心蛙状元测试卷系列答案【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成。为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性,经过思考设计并进行了以下实验:
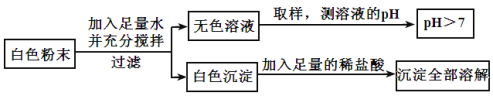
(1)白色粉末中一定不含_____________;可能含有____________。
(2)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(作出猜想)猜想Ⅰ:Na2CO3
猜想Ⅱ:NaOH
猜想Ⅲ:Na2CO3和NaOH
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
① 取无色滤液少许于试管中,滴加过量的BaCl2溶液 | ________ | 猜想Ⅱ不成立 |
② 在①反应后的试管中滴加________ | 溶液变为红色 | 猜想Ⅲ成立 |
(得出结论)白色粉末的成分是________________。
【题目】下列各组物质中,甲、乙、丙能实现如下图所示的转化关系的是(注:“→”表示反应一 步实现,部分物质和反应条件已略去)( )
甲 | 乙 | 丙 | |
① | H2O2 | O2 | H2O |
② | C | CO | CO2 |
③ | Fe | H2 | Cu |
④ | H2SO4 | HCl | HNO3 |
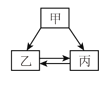
A. ①④B. ②③C. ①②D. ①②③④