题目内容
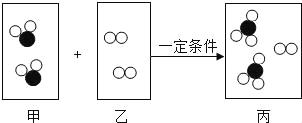
【题目】MgSO47H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3,其它成分忽略)为原料制备MgSO47H2O的主要流程如图:
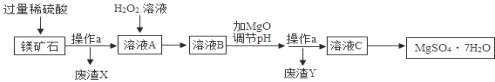
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3溶于稀硫酸的化学方程式为_____。
(2)为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 降低反应温度 C 用稀硫酸多次浸泡
(3)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为_____。
(4)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是_____。
(5)加氧化镁调节后溶液的pH范围是_____(用不等式表示)。
【答案】MgCO3+H2SO4=MgSO4+H2O+CO2↑ AC 2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 氢氧化钠和硫酸反应会生成新的杂质硫酸钠 3.2≤pH<9.1
【解析】
(1)MgCO3溶于稀硫酸的化学方程式为MgCO3+H2SO4=MgSO4+H2O+CO2↑。
(2)为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为将镁矿石粉碎增大接触面积、用稀硫酸多次浸泡,故选AC;
(3)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为:2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O。
(4)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是氢氧化钠和硫酸反应会生成新的杂质硫酸钠。
(5)由部分阳离子以氢氧化物形式沉淀时溶液的pH可知,加氧化镁调节后溶液的pH范围是3.2≤pH<9.1。

 阅读快车系列答案
阅读快车系列答案【题目】碳酸钡广泛应用于显像管、陶瓷、光学玻璃等行业,有一种碳酸盐矿石其主要成分为碳酸钡和碳酸钙,以此矿石为原料生产碳酸钡的流程如图所示。
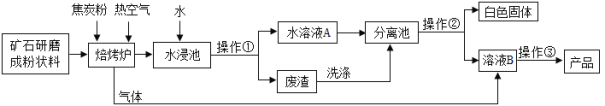
(查阅资料)
I.碳酸钡和碳酸钙具有相似的化学性质,氧化钡和氧化钙都能与水反应生成对应的碱,且生成物均能与二氧化碳反应。
Ⅱ.下表所示的是两种碱在不同温度下的溶解度
温度/℃ | 0 | 40 | 80 |
Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
(1)写出水浸池中氧化钙与水反应的化学方程式____________。
(2)以下相关说法正确的是________。
a焙烤炉中添加焦炭粉和热空气是为了维持炉内反应所需的高温状态;
b焙烤炉内只涉及分解反应;
c废渣需要经过洗涤才能弃渣,是为了保护环境,同时为了提高产率;
d该工艺流程可以减少CO2气体的排放,控制温室效应。
(3)除了水之外,进入分离池中的物质是_________,操作②的步骤是________(选填 “降温”、“加热”)、过滤。
(4)写出由溶液B制取产品碳酸钡的化学方程式:__________。