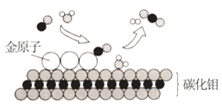
题目内容
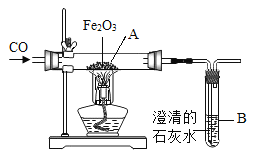
【题目】(1)为测定空气中氧气的含量,某课外活动小组对课本上的实验做了如下改进:如图1所示,在一个注射器和装有较多铜丝的硬质装璃管内共封闭80mL空气,然后给硬质玻璃管加热,并缓慢向右推动注射器的活塞。至硬质玻璃管内铜丝变黑且较长时间内无进一步变化时停止加热,待剩余气体冷却至室温。请回答:
①实验前,检查本装置气密性的一种方法是:先固定注射器的活塞,再用酒精灯加热硬质玻璃管,可观察到_____,说明气密性良好。
②实验结束后,注射器内气体的体积减少了约_______mL,这是因为______________。
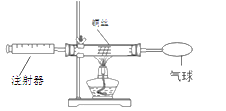
(2)课外活动小组发现红热的铜丝变黑后,为了回收再利用铜丝,在研究如何除去黑色物质的讨论中,制定了如图2所示的两种方案。请回答:(备注:A为氢氧化钠溶液,B为稀硫酸溶液)
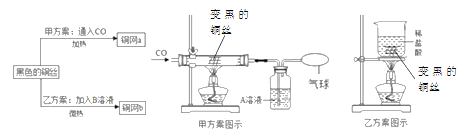
①甲方案的玻璃管中实验现象是__________,乙方案的烧杯中发生反应的化学方程式是___________。
②甲方案实验过程中,操作步骤正确的是__________(填序号)。
A实验开始时,先通入![]() ,再加热:实验结束时,先停止加热,再停止通入
,再加热:实验结束时,先停止加热,再停止通入![]()
B实验开始时,先加热,再通入![]() ;实验结束时,先停止加然,再停止通入
;实验结束时,先停止加然,再停止通入![]()
C实验开始时,先通入![]() ,再加热;实验结束时,先停止通入
,再加热;实验结束时,先停止通入![]() ,再停止加热
,再停止加热
D实验开始时,先加热,再通入![]() ;实验结束时,先停止通入
;实验结束时,先停止通入![]() ,再停止加然
,再停止加然
③两种方案相比,乙方案更好,其原因是_________________________。
【答案】气球迅速变大(其他正确描述均给分) 16 氧气的体积约占空气总体积的1/5 黑色固体变为红色 ![]() A 操作方便;节约能源;不会对环境造成污染(答对一点即给全分,其他合理答案均给分)
A 操作方便;节约能源;不会对环境造成污染(答对一点即给全分,其他合理答案均给分)
【解析】
(1)①实验前,检查本装置气密性的一种方法是:先固定注射器的活塞,再用酒精灯加热硬质玻璃管,可观察到气球迅速变大,说明气密性良好。
②空气中氧气占空气体积的五分之一,体积为80mL×![]() =16mL,故反应后体积减少了16mL。
=16mL,故反应后体积减少了16mL。
(2)①氧化铜是黑色固体,可以与一氧化碳反应生成铜和二氧化碳,故可以看到的现象是黑色固体变为红色。稀盐酸与氧化铜反应生成氯化铜和水,反应的方程式为:![]()
②一氧化碳还原氧化铜的实验中,为了防止爆炸需要先通入一氧化碳,在点燃酒精灯;实验结束后,为了防止炽热的铜被再次氧化,要先熄灭酒精灯,继续通入一段时间的一氧化碳,故选A.
③相比较而言乙方案操作方便;节约能源;不会对环境造成污染。

【题目】小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
(探究目的)探究所得溶液的酸碱性。
(提出猜想)所得溶液可能呈碱性,也可能呈______性。
(实验验证)
实验操作 | 实验现象 | 结论 |
用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 ______ | 溶液呈碱性 |
无色酚酞试液不变色 | 溶液呈 ______ |
(分析与思考)
(1)若溶液呈碱性,为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入______溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为______。
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入金属锌,若观察到______,则所取溶液星酸性;若无明显现象,则呈中性。
方案二:取样,加入碳酸钠溶液,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为______,若无明显现象,则呈中性。
(3)工业上常用氢氧化钠来中和废水中的盐酸,现取废液50g,逐滴滴入10%的氢氧化钠溶液中和,当溶液pH为7时,用去氢氧化钠溶液8g。请计算废水中氯化氢的质量分数______。
【题目】用如图所示装置进行下列实理验,实验结果与预测的现象不一致的是( )
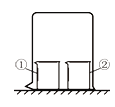
选项 | ①中的物质 | ②中的物质 | 预测①中的现象 |
A | 紫色石蕊试液 | 浓氨水 | 溶液由紫色变为蓝色 |
B | 氢氧化钡溶液 | 浓硫酸 | 有白色沉淀 |
C | 硫酸铜溶液 | 浓氨水 | 有蓝色沉淀 |
D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
A. AB. BC. CD. D