题目内容
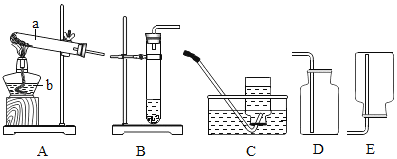
【题目】甲、乙同学利用如下装置验证氢氧化钠能与二氧化碳反应.(装置气密性良好)
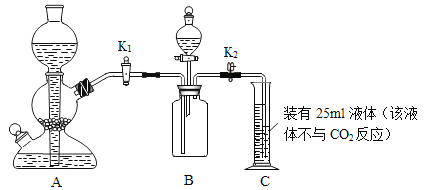
①装置A用于制取二氧化碳,写出装置A中制取二氧化碳的化学反应方程式____.
②使A中反应暂停的操作是____.
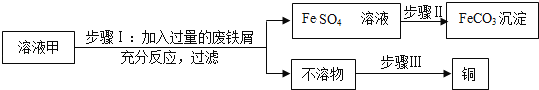
③甲同学打开装置B中分液漏斗活塞,将8mL室温时氢氧化钠饱和溶液滴入B中,然后关闭漏斗活塞,打开____(填K1或K2),观察到C中液体倒流至B中.甲同学得出结论,氢氧化钠能与二氧化碳反应.
乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验.请完成以下表格:(步骤同上,略)
分液漏斗内液体 | 现象 | 结论 |
甲同学:室温时8mL氢氧化钠饱和溶液. | 量筒中液体倒流入B中,且量筒内液面下降至10ml刻度处. | 二氧化碳与氢氧化钠发生反应. |
乙同学:____. | 量筒中液体倒流入B中,且量筒内液面下降至___10ml刻度处.(填“>”、“<”或“=”) |
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 关闭K1 K2 室温时8mL水 >
【解析】
①碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②使A中反应暂停应该关闭K1;故填:关闭K1;
③要使C中的液体回流,需要打开K2,故填:K2;
④进行对比实验,需要控制变量,取用氢氧化钠溶液的体积是8mL,则取用水的体积是8mL,发现量筒中液体倒流入B中,且量筒内液面下降至大于10ml刻度处,说明二氧化碳能与氢氧化钠反应,故填:室温时8mL水;>.

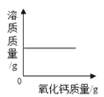
【题目】氯化钠与硝酸钾的部分溶解度如下(单位:g/100g水)。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |
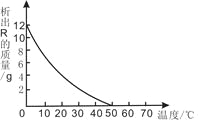
①请你根据表格中的数据,将氯化钠的溶解度曲线补充完成。(在虚线框内作图)____。

②在20℃时,将50克硝酸钾溶解在100克水中,形成的是____(填“饱和”或“不饱和”)溶液,若升温至40℃,则烧杯中溶液的溶质质量分数为____(精确到0.1%)
③某温度时,氯化钠与硝酸钾的溶解度相等均为S g/100g水,则S的最小范围是______。
④在固体硝酸钾中混有少量氯化钠可以通过溶解,蒸发浓缩,降温结晶,过滤等步骤分离提纯硝酸钾。可以利用该方法分离的理由是_____。
A 固体混合物中硝酸钾的含量较高,氯化钠的含量较低。
B 硝酸钾的溶解度受温度影响变化较大。
C 40℃至100℃,硝酸钾的溶解度始终大于氯化钠。