题目内容
(2011年浙江丽水,37题)氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含量进行测定,三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的稀硫酸,充分反应后,对烧杯中剩余固体进行称量,实验数据记录如下:
(1)分析表中数据可知,第2组实验中的剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
| 组别编号 | 样品质量(克) | 加入稀硫酸质量(克) | 剩余固体质量(克) |
| 1 | 10 | 20 | 8.4 |
| 2 | 10 | 30 | 8 |
| 3 | 10 | 40 | 8 |
(1)分析表中数据可知,第2组实验中的剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
(1)铜(或Cu) (2)80%
(3)解:设20克稀硫酸中溶质的质量为x
CuO + H2SO4 ="=" CuSO4 + H2O
98
(10g-8.4g) x
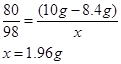
加入的稀硫酸溶质质量分数是: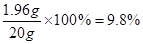
答:加入的稀硫酸溶质质量分数是9.8%。
(3)解:设20克稀硫酸中溶质的质量为x
CuO + H2SO4 ="=" CuSO4 + H2O
98
(10g-8.4g) x
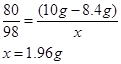
加入的稀硫酸溶质质量分数是:
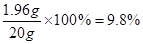
答:加入的稀硫酸溶质质量分数是9.8%。
分析:
(1)根据图示数据可知最后加入硫酸后固体质量不再减少,说明剩余的物质都是铜,再进行计算;(2)根据硫酸全部参加反应的一次进行计算根据氧化铜的质量算出硫酸质量.
解:(1)根据加入30g硫酸和加入40g硫酸剩余固体质量不变,说明剩余固体中已经不存在氧化铜,全部为铜,所以铜的质量为8g,所以样品中单质铜的质量分数为:
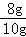 ×100%=80%;
×100%=80%;(2)根据第一个同学和第二个同学数据可知,第一个同学实验中硫酸全部参加了反应,且消耗氧化铜质量为:10g﹣8.4g=1.6g,设与1.6g氧化铜反应消耗硫酸质量为X则:
CuO+H2SO4═CuSO4+H2O
80 98
1.6g X
根据:
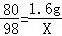 解得X=1.96g,所以加入的稀硫酸溶质质量分数是:
解得X=1.96g,所以加入的稀硫酸溶质质量分数是: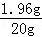 ×100%=9.8%.
×100%=9.8%.故答案为:(1)80%;(2)9.8%.

练习册系列答案
相关题目
 10CO2 +12H2O),可生成二氧化碳多少g?(计算结果保留一位小数)
10CO2 +12H2O),可生成二氧化碳多少g?(计算结果保留一位小数)