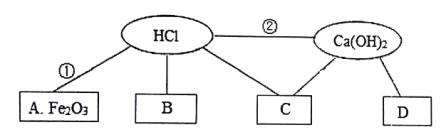
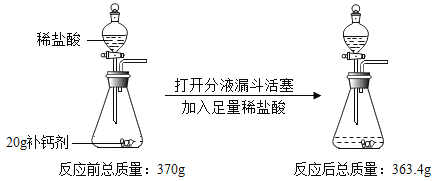
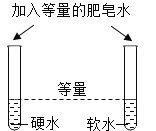
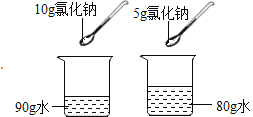
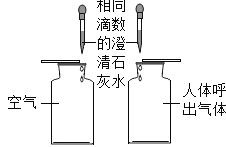
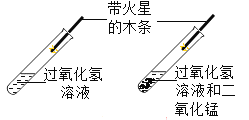
题目内容
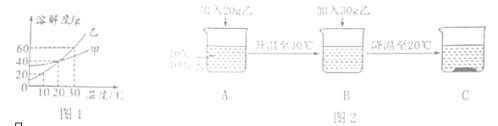
【题目】用质量分数为5%的稀硫酸和10%的氢氧化钾溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
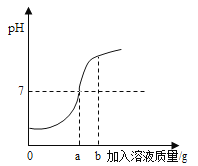
(1)该实验是将________(选填“稀硫酸”或“氢氧化钾洛液”)滴加到另一种溶液中。
(2)当加入溶液的质量a为28g时,求所得溶液中溶质的质量________。
【答案】氢氧化钾溶液 4.35g。
【解析】
(1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,进行分析确定操作的过程;
(2)根据溶质质量=溶液质量×溶质的质量分数,列式表示出当加入氢氧化钠溶液的质量为28g时溶质的质量,进而根据化学方程式计算出所得溶液中溶质的质量即可。
解:(1)由图象可知,pH值是开始时小于7逐渐的增大到7然后大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH升高,说明是把氢氧化钾溶液滴加到稀盐酸中;
(2)设溶液中溶质的质量为x,
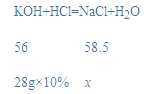
![]()
x=2.925g。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】将宏观、微观及化学符号相联系是化学学习的特点。下图中表格是元素周期表的部分信息,A、B、C、D是四种粒子的结构示意图,请回答下列问题。
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.07 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
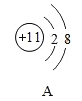
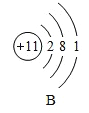
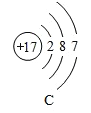
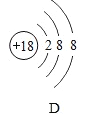
(1)硫原子的核外电子数为______;
(2)在四种粒子中,易得到电子,成相对稳定结构的是______,它们所对应的元素种类有______种;
(3)图A所示的粒子可用化学符号表示为______。