题目内容
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
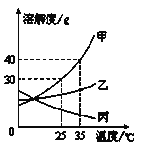
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(2)若甲固体中含有少量乙,则提纯甲的方法是 (填“蒸发结晶、降温结晶”之一)。
(3)将25℃时乙的饱和溶液升温到35℃,则其溶液的溶质质量分数 (填“变大”、“变小”或“不变”)
(4)35℃时,分别用等质量的甲、乙、丙配制该温度下的饱和溶液,所得溶液的质量最小的是 。
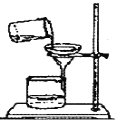
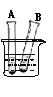
(5)如图所示,35℃时,A、B两试管中分别盛有甲、丙的饱和溶液,并都有少量固体存在。若向试管外盛有水的烧杯中加入某固体物质后,A试管内固体明显减少,B试管内固体逐渐增多。则加入的物质可能是 (写出一种物质的化学式)。
【答案】(1)65 ;(2)降温结晶;(3)不变;(4)甲; (5)氢氧化钠或氧化钙
【解析】试题分析:(1)从溶解度曲线可知,25℃时,100g水最多溶解30g甲,则50g水应溶解15g甲 达到饱和,所得溶液的质量是50g+15g=65g;
(2)甲的溶解度受温度影响变化较大,乙的溶解度受温度的变化影响较小,所以,甲固体中含有少量乙,则提纯甲的方法是降温结晶;
(3)将25℃时乙的饱和溶液升温到35℃,乙变成不饱和溶液,在变化过程中,溶质的质量和溶剂的质量都没有发生变化,所以,溶质的质量分数不变;
(4) 35℃时,分别用等质量的甲、乙、丙配制该温度下的饱和溶液,溶解度大的需要水的质量反而小,因此,甲的溶液质量最小;
(5) A试管中盛有甲的饱和溶液,B试管中盛有丙的饱和溶液,甲的溶解度随温度升高而增大,丙的溶解度随温度升高而减小,向试管外盛有水的烧杯中加入某固体物质后,A试管内固体明显减少,说明加入烧杯中的物质溶解时温度升高,常见的物质如氢氧化钠、氧化钙等。

 阅读快车系列答案
阅读快车系列答案