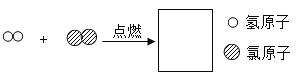
题目内容
【题目】水和溶液对人类的生产、生活具有重要的意义,请结合所学知识回答下列问题。
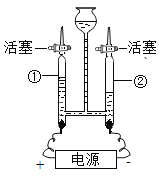
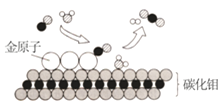
(1)如图是电解水的装置,玻璃管②中收集到的气体是_____________,该实验说明水是由_________________组成的。
(2)硬水会给生产和生活带来许多麻烦。加入___________ 可检验水是否为硬水。生活中常用_________________的方法来降低水的硬度。长期使用硬水容易使盛水器具结水垢,水垢的主要成分是氢氧化镁和碳酸钙,可用稀盐酸除去,请写出稀盐酸与氢氧化镁反应的化学方程式__________________。
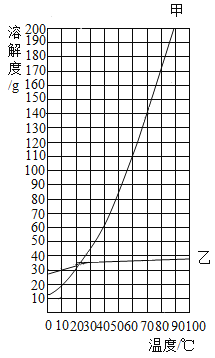
(3)如图是甲、乙两种固体物质的溶解度曲线图。请结合图示回答下列问题。
①在10 ℃时,甲、乙两种物质的溶解度大小关系为_______________。
②某温度下,将甲的不饱和溶液转化为饱和溶液的方法之一是__________________。
③取一定量的甲物质和水进行如图所示操作:
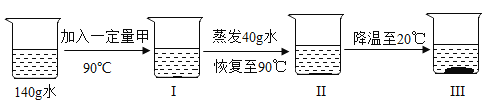
若Ⅲ中析出116 g固体(不含结晶水),则下列对上述过程的分析,正确的是_________。
AⅠ中溶液为不饱和溶液
BⅡ中溶液可能是饱和溶液
CⅢ中溶液质量为216 g
D开始析出固体甲的温度在70 ℃至80 ℃之间
【答案】氢气 氢元素和氧元素 肥皂水 煮沸 2HCl+Mg(OH)2=MgCl2+2H2O 甲<乙 加甲固体物质(或恒温蒸发溶剂) AD
【解析】
电解水正极生成氧气,负极生成氢气,稀盐酸与氢氧化镁反应生成氯化镁和水。
(1)电解水正极生成氧气,负极生成氢气,玻璃管②和负极相连,收集到的气体是氢气,实验说明水是由氢元素和氧元素组成的。
(2)加入肥皂水可检验水是否为硬水,产生泡沫较多的为软水,泡沫较少的为软水。生活中常用煮沸的方法来降低水的硬度。长期使用硬水容易使盛水器具结水垢,稀盐酸与氢氧化镁反应生成氯化镁和水,反应的化学方程式为2HCl+Mg(OH)2=MgCl2+2H2O。
(3)①由甲、乙两种固体物质的溶解度曲线图可知,在10 ℃时,甲、乙两种物质的溶解度大小关系为甲<乙。
②甲的溶解度随温度的升高而增大,某温度下,将甲的不饱和溶液转化为饱和溶液的方法是加甲固体物质(或恒温蒸发溶剂)。
③A、由图可知,加入一定量的甲物质,蒸发40g水,没有晶体析出,则Ⅰ中溶液为不饱和溶液,故A正确;
B、由溶解度曲线可知,20℃100g水中可以溶解35g甲,Ⅲ中析出116 g固体,说明开始加入一定量的甲物质质量为35g+116g=151g;90℃时甲的溶解度大于151g,Ⅱ中溶液一定是不饱和溶液,故B不正确;
C、Ⅲ中溶液质量为100g+35g=135g,故C不正确;
D、加入一定量的甲物质质量为151g,由溶解度曲线可知,开始析出固体甲的温度在70 ℃至80 ℃之间,故D正确。故选AD。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】碳元素是组成许多物质的基本元素。
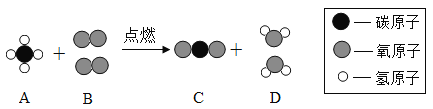
甲烷在自然界的分布很广,和水反应可以制水煤气(混合气体),其反应的微观示意图如下所示:
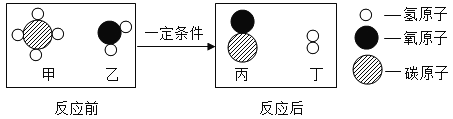
(1)该反应中含有氢元素的化合物有_________(用化学式表示);该反应中生成的两种分子的物质的量之比为_________。
(2)分析下表,与煤相比,用天然气作燃料的优点有________。
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/kJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |
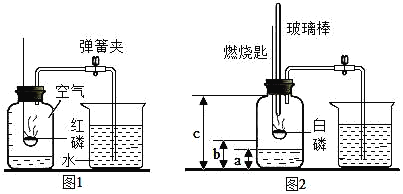
【题目】二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,我们可以用图1所示装置来测定空气中氧气的含量,请写出红磷燃烧的符号表达式_________________,该反应属于_________________反应(填一种基本反应类型)。
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)_______________,导致装置内氧气有剩余;(3)……
(实验与交流)在老师的指导下,同学们查阅了白磷、红磷等物质燃烧需要的最低含氧量如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用上述过量红磷、白磷、蜡烛三种物质进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度会不断变小,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与澄清石灰水反应。根据以上信息回答下列问题:
(1)白磷和红磷相比,使用白磷能使结果更准确,其原因是______________________。
(2)请写出木炭燃烧的符号表达式_________________;有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是________________。
(实验改进)小邹同学改进了教材中的实验,设计出了如图2所示的实验装置。实验步骤如下:
①如图2所示,连接仪器,检查装置的气密性,发现装置的气密性良好。
②在集气瓶里装进a体积的水,燃烧匙里放一块白磷(白磷燃烧所需要的最低温度是40℃),按图示装置把集气瓶中的空气密封起来。(注:集气瓶内的长导管已伸到了瓶底)。
③用力把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即燃烧,产生大量白烟,放出大量的热。
④待白磷燃烧熄灭后,振荡集气瓶,白烟消失。
⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c。
⑥根据a、b、c三个数据,计算出空气中氧气的体积分数。根据以上信息,回答下列问题;
(1)在白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化情况是_______。
(2)若实验非常成功,当c为500mL,a=100mL,则b= _______mL。
(3)组内成员小张对“实验前集气瓶里要装进适量a体积的水”非常不理解。咨询了组长小明之后,他终于明白“a体积的水”的作用,其一是为了加快步骤⑤中集气瓶的冷却速度;其二则主要是______________。
(4)在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值大于理论值的是_______________(填字母)。
A用蜡烛代替白磷
B集气瓶没有冷却到室温
C实验前集气瓶里没有装a体积的水
【题目】制取二氧化碳是初中化学8个基础实验之一。
(1)按下表进行实验,取等质量的大理石加入足量的酸中(设杂质不与酸反应),产生的二氧化碳体积随时间的变化曲线如图所示:
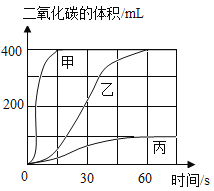
实验编号 | 药品 |
I | 块状大理石、10%稀硫酸溶液 |
Ⅱ | 块状大理石、7%稀盐酸溶液 |
Ⅲ | 粉末状大理石、7%稀盐酸溶液 |
①实验Ⅱ对应的曲线是乙,反应的文字表达式为 _______。对照实验室制气体的要求,确定可用实验Ⅱ的药品来制备二氧化碳气体。
②实验I对应的曲线是 _______。
③实验室不选用实验Ⅲ的药品来制备二氧化碳,理由是 _______ 。
(2)当反应原理确定后,就能以此来选择反应的发生装置了。
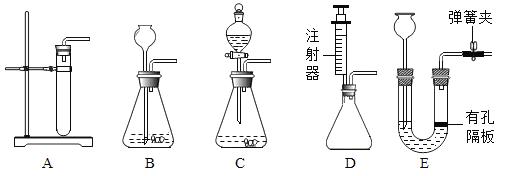
①实验室制取气体,通常根据_____和反应条件等因素选择发生装置。
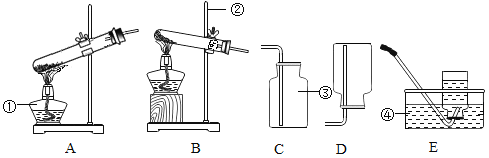
②二氧化碳的发生装置可以选用下图中的装置B、E和________(填字母);装置E相较于装置B,优点是_____ 。
(3)现用氧气传感器分别测定向上排空气法和排水法收集的等体积两瓶CO2气体中氧气的体积分数(数据如图),然后换算出瓶内空气的体积分数(以O2占空气体积的1/5计算),最后推算得到实际收集的气体中CO2的体积分数。下列说法正确的是_______填字母)。
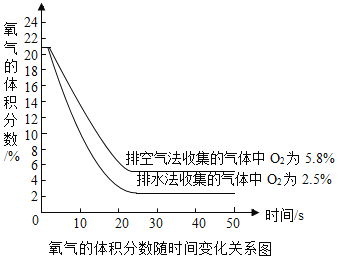
A 向上排空气法收集二氧化碳时,将燃着小木条置于瓶口,当火焰熄灭时,集气瓶中CO2的体积分数为100%
B 上图中用向上排空气法收集的气体中 CO2的体积分数约为94. 2%
C 上图中用排水法收集的气体中 CO2的体积分数约为87.5%
D 相比于向上排空气法,排水法收集的 CO2纯度较高