题目内容
【题目】化学实验小组设计如图装置,通过测定产生相同体积气体所用时间长短来探究影响双氧水分解速率的因素。
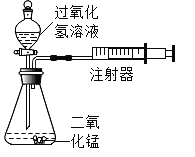
(1)检查该装置气密性的方法是关闭分液漏斗活塞,用力将注射器活塞拉出(右移),停止用力后,若观察到_______________,则气密性良好。
(2)如图反应的符号表达式为_____________。
(3)实验小组有如下设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 所需时间 |
实验Ⅰ | 探究_______对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 | 60秒 |
实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 | 30秒 |
由上表数据可知:双氧水的浓度越大,其分解速率__________,影响双氧水分解速率的因素可能还有_________________。
(4)催化剂在生产、生活和科研中的地位越来越重要。实验室用过氧化氢溶液分解制取氧气时,就常用二氧化锰作催化剂。
(提出问题)氧化铜(CuO)能否起到类似MnO2的催化剂作用呢?
(猜想假设)猜想一:CuO不是该反应的催化剂。
猜想二:CuO参与反应产生O2,反应前后质量和化学性质发生了改变。
猜想三:CuO是反应的催化剂,反应前后_____________。
(实验探究)用天平称量0.2 g CuO,取5 mL 5%的过氧化氢溶液于试管中,进行如下实验:

(注:氧化铜不溶于水,过滤可与水分离)
(交流讨论)
(1)填写下表:
步骤③现象 | 步骤⑤结果 | 结论 |
产生大量的气泡,带火星的木条________。 | 得到氧化铜的质量为_______g。 | 猜想一、二不成立; 猜想三成立。 |
(2)步骤①的目的是____________。步骤④需用到的玻璃仪器有:玻璃棒、烧杯和_________,其中玻璃棒的作用是___________。
(3)步骤⑥重复实验②、③的目的是___________。
【答案】活塞恢复原位  过氧化氢溶液浓度 越快 温度(或催化剂的种类等) 质量和化学性质不变 复燃 0.2 对照实验 漏斗 引流 检验氧化铜在反应前后化学性质是否改变
过氧化氢溶液浓度 越快 温度(或催化剂的种类等) 质量和化学性质不变 复燃 0.2 对照实验 漏斗 引流 检验氧化铜在反应前后化学性质是否改变
【解析】
过氧化氢在二氧化锰催化作用下生成水和氧气。
(1)检查该装置气密性的方法是关闭分液漏斗活塞,用力将注射器活塞拉出(右移),停止用力后,若观察到活塞恢复原位,则气密性良好。
(2)过氧化氢在二氧化锰催化作用下生成水和氧气,故反应的符号表达式为 。
。
(3)由图1两个实验对比可以看出实验Ⅱ中催化剂与实验Ⅰ中的相同,而过氧化氢浓度不同,因此甲组的实验目的为探究浓度对速率的影响
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 所需时间 |
实验Ⅰ | 探究过氧化氢溶液浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 | 60秒 |
实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 | 30秒 |
由上表数据可知:双氧水的浓度越大,其分解速率越快,影响双氧水分解速率的因素可能还有温度(或催化剂的种类等)。
(4)[猜想假设]
猜想一:CuO不是该反应的催化剂。
猜想二:CuO参与反应产生O2,反应前后质量和化学性质发生了改变。
猜想三:CuO是反应的催化剂,反应前后质量和化学性质不变。
[交流讨论]
(1)过氧化氢在催化剂催化作用下生成水和氧气,催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变。
步骤③现象 | 步骤⑤结果 | 结论 |
产生大量的气泡,带火星的木条复燃。 | 得到氧化铜的质量为0.2g。 | 猜想一、二不成立; 猜想三成立。 |
(2)氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,步骤①的目的是对照实验。步骤④是过滤,需用到的玻璃仪器有:玻璃棒、烧杯和漏斗,其中玻璃棒的作用是引流。
(3)步骤⑥重复实验②、③的目的是检验氧化铜在反应前后化学性质是否改变。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案