题目内容
KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | ||
| 溶解度/g/100g水 | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
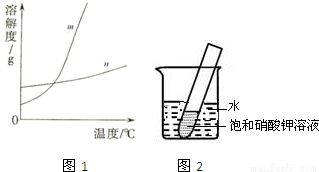
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,图1中能表示KNO3溶解度曲线的是 .(填m或n)
(2)由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是 .
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为 克.
(4)在30℃时,50g水中加入25g硝酸钾,充分搅拌后得到得到的溶液质量为 g.
(5)如图2所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的 (填字母序号).
A.生石灰固体 B.冰块.
【答案】分析:(1)对溶解度随温度变化明显与不明显;硝酸钾的溶解度受温度影响变化较大.
(2)硝酸钾和氯化钠溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能.
(3)由10℃时硝酸钾的溶解度可以计算出蒸发10g水后可析出KCl晶体的质量.
(4)30℃时硝酸钾的溶解度为45.8g.
(5)由于硝酸钾的溶解度随温度的升高而明显增大,硝酸钾的饱和溶液中有晶体析出,说明温度降低了,因此加入的物质应是溶于水吸热的物质.
解答:解:(1)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,故m能表示KNO3溶解度曲线的.
(2)硝酸钾和氯化钾溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能,经分析知在20~30℃时这两种物质存在溶解度相同的可能.x的取值范围是34.0g<x<37.0g.
(3)10℃时,硝酸钾的溶解度为31g,10g水中最多能溶解3.1g硝酸钾.故蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g.
(4)30℃时硝酸钾的溶解度为45.8g.所以在30℃时,50g水中加入25g硝酸钾,最多溶解22.9g,所以充分搅拌后得到得到的溶液质量为72.9g.
(5)由于硝酸钾的溶解度随温度的升高而明显增大,硝酸钾的饱和溶液中有晶体析出,说明温度降低了,因此加入的物质应是溶于水吸热的物质.冰溶于水吸热,温度降低.
故答案为:(1)m;(2)34.0g<x<37.0g;(3)3.1; (4)72.9; (5)B.
点评:本题难度不大,主要考查了根据固体的溶解度曲线解决相关的问题,从而培养学生对知识的理解和应用.
(2)硝酸钾和氯化钠溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能.
(3)由10℃时硝酸钾的溶解度可以计算出蒸发10g水后可析出KCl晶体的质量.
(4)30℃时硝酸钾的溶解度为45.8g.
(5)由于硝酸钾的溶解度随温度的升高而明显增大,硝酸钾的饱和溶液中有晶体析出,说明温度降低了,因此加入的物质应是溶于水吸热的物质.
解答:解:(1)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,故m能表示KNO3溶解度曲线的.
(2)硝酸钾和氯化钾溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能,经分析知在20~30℃时这两种物质存在溶解度相同的可能.x的取值范围是34.0g<x<37.0g.
(3)10℃时,硝酸钾的溶解度为31g,10g水中最多能溶解3.1g硝酸钾.故蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g.
(4)30℃时硝酸钾的溶解度为45.8g.所以在30℃时,50g水中加入25g硝酸钾,最多溶解22.9g,所以充分搅拌后得到得到的溶液质量为72.9g.
(5)由于硝酸钾的溶解度随温度的升高而明显增大,硝酸钾的饱和溶液中有晶体析出,说明温度降低了,因此加入的物质应是溶于水吸热的物质.冰溶于水吸热,温度降低.
故答案为:(1)m;(2)34.0g<x<37.0g;(3)3.1; (4)72.9; (5)B.
点评:本题难度不大,主要考查了根据固体的溶解度曲线解决相关的问题,从而培养学生对知识的理解和应用.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
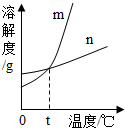 KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示.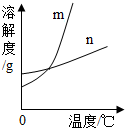 (2013?河东区二模)KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:
(2013?河东区二模)KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题: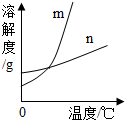 KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题: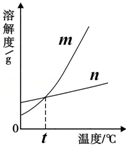 KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示. KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题: