题目内容
 KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度 | KNO3 | 13.3 | 20.9 | 31,6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| /g | KCl | 27.6 | 31.0 | 34.0 | 370. | 40.0 | 42.6 | 45.5 | 48.3 |
m
m
.(填m或n)(2)60℃时,向两个分别盛有50gKCl和KNO3的烧杯中,各加入l00g的水,充分溶解后,为饱和的是
KCl
KCl
溶液.(3)采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液.下列说法正确的是
B
B
(填字母序号).A.溶质的质量不变
B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变
D.可升高温度或增加溶剂.
分析:(1)对溶解度随温度变化明显与不明显;硝酸钾的溶解度受温度影响变化较大.
(2)依据60℃时两者的溶解度进行判断即可.
(3)根据表格中的数据并结合饱和溶液和不饱和溶液的转化方法进行分析并完成解答.
(2)依据60℃时两者的溶解度进行判断即可.
(3)根据表格中的数据并结合饱和溶液和不饱和溶液的转化方法进行分析并完成解答.
解答:解:(1)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,故m能表示KNO3溶解度曲线的.
(2)60℃时硝酸钾的溶解度是110g,氯化钾的溶解度是45g,所以60℃时,50gKCl和KNO3的固体,各加入l00g的水充分溶解氯化钾能成为饱和溶液;
(3)A、剩余固体溶解,所以溶液中溶质的质量增加,故A说法错误;
B、根据表中数据可以知道升高温度不能形成氯化钾的不饱和溶液,所以只有加入水才能得到不饱和溶液,所以质量分数一定减小,故B说法正确;
C、溶质质量增加,溶液质量一定增加,故C说法错误;
D、要使溶液中的溶质继续溶解,可采取增加溶剂的方法,升高温度不能让氯化钾的溶液变成不饱和,故D说法错误.
故答案为:(1)m;(2)KCl;(3)B;
(2)60℃时硝酸钾的溶解度是110g,氯化钾的溶解度是45g,所以60℃时,50gKCl和KNO3的固体,各加入l00g的水充分溶解氯化钾能成为饱和溶液;
(3)A、剩余固体溶解,所以溶液中溶质的质量增加,故A说法错误;
B、根据表中数据可以知道升高温度不能形成氯化钾的不饱和溶液,所以只有加入水才能得到不饱和溶液,所以质量分数一定减小,故B说法正确;
C、溶质质量增加,溶液质量一定增加,故C说法错误;
D、要使溶液中的溶质继续溶解,可采取增加溶剂的方法,升高温度不能让氯化钾的溶液变成不饱和,故D说法错误.
故答案为:(1)m;(2)KCl;(3)B;
点评:本题难度不大,主要考查了根据固体的溶解度曲线解决相关的问题,从而培养学生对知识的理解和应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示. (2013?河东区二模)KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:
(2013?河东区二模)KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题: KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示.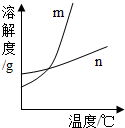 KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题: