题目内容
 KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(1)20℃时,KNO3的溶解度是
31.6g或31.6g/100g水
31.6g或31.6g/100g水
.(2)30℃时,将KNO3和KCl固体各40g分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是
KCl
KCl
.将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的一种方法是加溶质KNO3或恒温蒸发溶剂水
加溶质KNO3或恒温蒸发溶剂水
.(3)依据上表中数据,已绘制出KNO3和KCl的溶解度曲线(如右图所示),图中能表示KNO3溶解度曲线的是
m
m
(填“m”或“n”).(4)从含有少量KCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用的方法是
冷却热饱和溶液(或降温结晶)
冷却热饱和溶液(或降温结晶)
.(5)由表中数据分析可知,KNO3和KCl在某一温度t时具有相同的溶解度,则t的取值范围是
20℃~30℃
20℃~30℃
.分析:(1)根据表中的数据,查出 20℃时KNO3的溶解度;
(2)根据表中的数据,根据硝酸钾和氯化钾在30℃时的溶解度判断属于饱和溶液的是何种物质;并据饱和溶液、不饱和溶液的相互转化分析解答;
(3)根据表中的数据分析,KNO3的溶解度随温度变化的情况,找出对应的曲线;
(4)根据硝酸钾、氯化钾的溶解度变化分析提纯硝酸钾的方法;
(5)对比硝酸钾和氯化钾不同温度下的溶解度,分析溶解度相同时对应的温度范围.
(2)根据表中的数据,根据硝酸钾和氯化钾在30℃时的溶解度判断属于饱和溶液的是何种物质;并据饱和溶液、不饱和溶液的相互转化分析解答;
(3)根据表中的数据分析,KNO3的溶解度随温度变化的情况,找出对应的曲线;
(4)根据硝酸钾、氯化钾的溶解度变化分析提纯硝酸钾的方法;
(5)对比硝酸钾和氯化钾不同温度下的溶解度,分析溶解度相同时对应的温度范围.
解答:解:(1)由表中的信息可查出:20℃时,KNO3的溶解度为31.6g;
(2)由表中的数据可知:在30℃时,KCl的溶解度是37g,硝酸钾的溶解度是45.8g,故将KNO3和KCl固体各40g分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是氯化钾;得到的是硝酸钾的不饱和溶液,若将硝酸钾的不饱和溶液转化为该温度下的饱和溶液,可采用加入硝酸钾和恒温蒸发溶剂的方法;
(3)由表格中数值可知硝酸钾的溶解度随着温度升高,溶解度变化较大,氯化钾的溶解度受温度影响较小,所以溶解度曲线中受温度影响较大的是硝酸钾,所以m曲线是硝酸钾的溶解度曲线;
(4)由表格中数值可知硝酸钾的溶解度随着温度升高,溶解度变化较大,氯化钾的溶解度受温度影响较小,所以从含有少量KCl的KNO3饱和溶液中得到较多的KNO3晶体,可用冷却热饱和溶液或降温结晶的方法;
(5)由表中的硝酸钾和氯化钾不同温度下的溶解度数据可知:若两物质的溶解度相等,此时所对应的温度范围在20℃~30℃;
故答案为:
(1)31.6g或31.6g/100g水;
(2)KCl;加溶质KNO3或恒温蒸发溶剂水;
(3)m;
(4)冷却热饱和溶液(或降温结晶);
(5)20℃~30℃.
(2)由表中的数据可知:在30℃时,KCl的溶解度是37g,硝酸钾的溶解度是45.8g,故将KNO3和KCl固体各40g分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是氯化钾;得到的是硝酸钾的不饱和溶液,若将硝酸钾的不饱和溶液转化为该温度下的饱和溶液,可采用加入硝酸钾和恒温蒸发溶剂的方法;
(3)由表格中数值可知硝酸钾的溶解度随着温度升高,溶解度变化较大,氯化钾的溶解度受温度影响较小,所以溶解度曲线中受温度影响较大的是硝酸钾,所以m曲线是硝酸钾的溶解度曲线;
(4)由表格中数值可知硝酸钾的溶解度随着温度升高,溶解度变化较大,氯化钾的溶解度受温度影响较小,所以从含有少量KCl的KNO3饱和溶液中得到较多的KNO3晶体,可用冷却热饱和溶液或降温结晶的方法;
(5)由表中的硝酸钾和氯化钾不同温度下的溶解度数据可知:若两物质的溶解度相等,此时所对应的温度范围在20℃~30℃;
故答案为:
(1)31.6g或31.6g/100g水;
(2)KCl;加溶质KNO3或恒温蒸发溶剂水;
(3)m;
(4)冷却热饱和溶液(或降温结晶);
(5)20℃~30℃.
点评:解答本题关键是要知道溶解度曲线的意义,及对溶解度知识的具体应用,对学生深入理解溶解度的概念、及饱和溶液和不饱和溶液的相互转化有一定的帮助.

练习册系列答案
相关题目
 (2013?河东区二模)KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:
(2013?河东区二模)KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题: KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题: KNO3和KCl在不同温度时的溶解度如下表所示.
KNO3和KCl在不同温度时的溶解度如下表所示.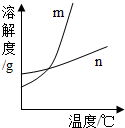 KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题: