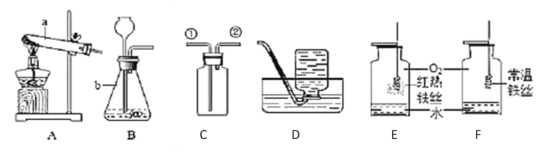
题目内容
【题目】某废液中含有Cu(NO3)2、AgNO3,取一定量的废液,加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液。向滤渣中加入稀盐酸,有气泡产生。
(1)滤渣中一定含有的金属是哪几种(写元素符号)_____?
(2)反应后溶液的质量减小,原因是什么_____?
(3)写出能生成红色固体的化学方程式_____。
【答案】Fe、Cu、Ag 参加反应的铁粉的质量小于生成的银和铜的质量 ![]()
【解析】
金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,且金属活动性差距越大,反应越易发生。氢前的金属能与稀盐酸反应,氢后的金属不与稀盐酸反应。向含有Cu(NO3)2 、AgNO3的混合溶液中加入一定量的铁粉,依次发生的反应是:Fe+2AgNO3=2Ag+ Fe(NO3)2、Fe+Cu(NO3)2= Fe(NO3)2 + Cu。过滤,得到滤渣和滤液。向滤渣中加入稀盐酸,有气泡产生,则滤渣中含有铁,说明加入的铁是过量的。
(1)由于铁过量,滤渣中一定含有的金属是生成的Cu、Ag,以及剩余的Fe。
(2)![]() ,
,![]() ,由以上反应可知,反应后都是固体质量增多,根据质量守恒定律,即反应后溶液的质量减小。
,由以上反应可知,反应后都是固体质量增多,根据质量守恒定律,即反应后溶液的质量减小。
(3)生成的红色固体是铜,反应的化学方程式是:Fe+Cu(NO3)2= Fe(NO3)2 + Cu

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目