题目内容
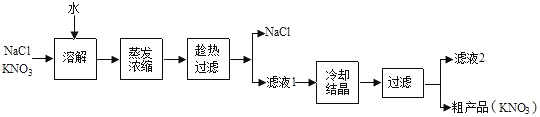
【题目】在学习中我们了解到常用制取氧气的方法有如图所示的四种:
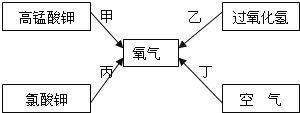
请回答问题:
(1)工业上常采用途径丁来制取氧气,这种方法是_______(填“物理”或“化学”)变化.以绿色化学的理念,你认为甲、乙、丙三种制取氧气的途径中,________(填“甲”、“乙”或“丙”)途径更能体现化学实验的绿色化追求.
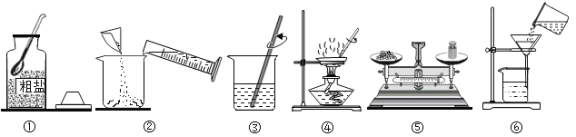
(2)下列是实验室制取氧气的一些装置,请回答有关问题
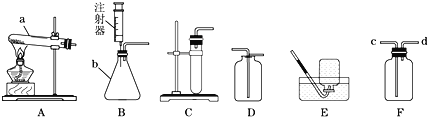
①写出a、b仪器的名称:a_______________,b_________________.
②实验室采用途径甲制取氧气,应选用的发生装置是_______(填编号),试管口要放______,目的是 ____________,该反应的文字表达式是_________。
③采用途径乙制取氧气的文字表达式是___________,如需随时控制生成气体的量并节约药品,发生装置最好选用__________(填编号),如用D装置收集氧气,检验氧气是否收集满的方法是____________。
④F装置中充满水时,也可以作为氧气的收集装置,则氧气应从______(填“c”或“d”)端通入.
(3)小明用收集好的氧气进行铁丝燃烧实验,写出该反应的文字表达式 ________;实验时在集气瓶中装少量水,目的是为了防止 _______ 。
(4)实验室中可以用加热氯化铵和氢氧化钙固体混合物的方法制得氨气。氨气极易溶于水,且密度小于空气。实验室中制取氨气的发生和收集装置为_____、____。(填序号)
【答案】物理 乙 试管 锥形瓶 A 一团棉花 防止高锰酸钾粉末进入导管使导管堵塞 高锰酸钾 ![]() 锰酸钾+二氧化锰+氧气 过氧化氢
锰酸钾+二氧化锰+氧气 过氧化氢![]() 水+氧气 B 将带火星的木条放在集气瓶口,若复燃则满 d 铁+氧气
水+氧气 B 将带火星的木条放在集气瓶口,若复燃则满 d 铁+氧气![]() 四氧化三铁 高温熔化物溅落使瓶底破裂 A F
四氧化三铁 高温熔化物溅落使瓶底破裂 A F
【解析】
高锰酸钾加热生成锰酸钾、二氧化锰和氧气,过氧化氢在二氧化锰催化作用下生成水和氧气,铁丝在氧气中点燃生成四氧化三铁。
(1)工业上分离液态空气制取氧气,根据液态氧和液态氮的沸点不同而分离出氧气,所以是物理变化;甲、乙、丙三种制取氧气的途径中,加热氯酸钾和二氧化锰或加热高锰酸钾制取氧气需要加热,浪费能源还污染环境,过氧化氢制取氧气,装置操作简单、安全,不需加热,生成物是水和氧气,无污染,更能体现化学实验的绿色化追求,故乙途径的更能体现化学实验的绿色化追求。
(2)①写a、b仪器的名称:a是试管,b是锥形瓶。
②途径甲是高锰酸钾加热生成锰酸钾、二氧化锰和氧气,实验室采用途径甲制取氧气,应选用的发生装置是A,试管口要放一团棉花,目的是防止高锰酸钾粉末进入导管使导管堵塞,反应的文字表达式是高锰酸钾![]() 锰酸钾+二氧化锰+氧气。
锰酸钾+二氧化锰+氧气。
③途径乙是过氧化氢在二氧化锰催化作用下生成水和氧气,故采用途径乙制取氧气的文字表达式是过氧化氢![]() 水+氧气,如需随时控制生成气体的量并节约药品,发生装置最好选用B,如用D装置收集氧气,检验氧气是否收集满的方法是将带火星的木条放在集气瓶口,若复燃则满 。
水+氧气,如需随时控制生成气体的量并节约药品,发生装置最好选用B,如用D装置收集氧气,检验氧气是否收集满的方法是将带火星的木条放在集气瓶口,若复燃则满 。
④F装置中充满水时,也可以作为氧气的收集装置,氧气要短进,水从长管排出,则氧气应从d端通入。
(3)铁丝在氧气中点燃生成四氧化三铁,反应的文字表达式为铁+氧气![]() 四氧化三铁;实验时在集气瓶中装少量水,目的是为了防止高温熔化物溅落使瓶底破裂。
四氧化三铁;实验时在集气瓶中装少量水,目的是为了防止高温熔化物溅落使瓶底破裂。
(4)实验室中可以用加热氯化铵和氢氧化钙固体混合物的方法制得氨气,发生装置应该为固固加热装置,故选A装置。氨气极易溶于水,且密度小于空气,用向下排空气法收集,收集装置应该选F。故实验室中制取氨气的发生和收集装置为A、F。

【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
(假设)H2O2生成O2的快慢与催化剂种类有关。
(实验方案)常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
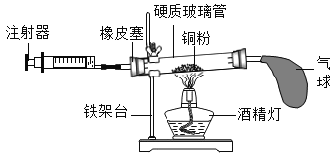
(进行实验)下图是他们进行实验的装置图,气体发生装置中A仪器的名称是(1)_________,此实验中B处宜采用的气体收集方法是(2)_________。
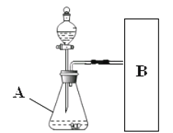
(实验记录)
实验编号 | 1 | 2 |
反应物 | 5%H2O2 | 5%H2O2 |
催化剂 | 1g水泥块 | 1gMnO2 |
时间 | 165s | 46s |
(结论)该探究过程得出的结论是(3)_____________。
(反思)H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的(4)______和(5)______是否改变。
(实验拓展)H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入5mL 5%的过氧化氢溶液,然后加入等量的二氧化锰。 | 缓慢有少量气泡冒出 | (6)___________ |
另取一支试管加入5mL 15%的过氧化氢溶液,然后加入等量的二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入5mL 15%的过氧化氢溶液,把试管放入盛有冷水的烧杯中 | (9)______ | 温度越高,过氧化氢分解的速率越大 |
取一支试管加入5mL(7)___ 的过氧化氢溶液,把试管放入盛有(8)___ 的烧杯中 | (10)______ |
【题目】铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上![]() 铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因
铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因![]() 请回答下列问题:
请回答下列问题:
(1)铁生锈的主要条件是铁与 ______和______直接接触.
(查阅资料)一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性强的金属首先被腐蚀![]() 造船①工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是 ______(填编号)
造船①工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是 ______(填编号)
A银块 B铜块 C锡块 D锌块
②为了防止铁生锈造成金属资源损耗,生活生产中很多铁制品是不锈钢的,不锈钢是一种 ______(填“合金”或“纯金属”).
(2)某化学兴趣小组对Mg,Cu,Cr的金属活动性顺序进行了探究,过程如下:
(提出假设)对三种金属的活动性顺序提出的三种可能的假设:
a Mg>Cr>Cu b Cr>Mg>Cu c______
相同温度下,取质量相等、表面积相同、光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
金属 | Cr | Mg | Cu |
与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | ______ |
①完成表格空白处
②上述三种金属的活动性由强到弱的顺序是______.
③从上述探究实验可知,Cr ______(填“能”或“不能)”跟CuSO4溶液反应![]() 若反应,请写出反应的化学方程式 ______.
若反应,请写出反应的化学方程式 ______.
④小明同学提出用硫酸铜溶液代替上述实验中盐酸也能得出三种金属的活动性顺序,小李认为不可行,其理由是______
⑤小张认为只要选用三种试剂就可以得出三种金属的活动性顺序,其中有一种选用CrSO4溶液另两种试剂是______、______.