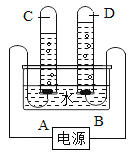
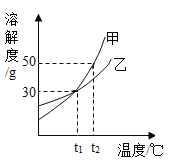
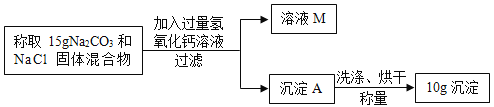
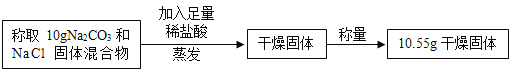
题目内容
【题目】从微观角度了解物质及其变化,更有利于认识物质组成和变化的本质。
(1)下图是![]() 元素在周期表中的信息和部分元素的原子结构示意图:
元素在周期表中的信息和部分元素的原子结构示意图:
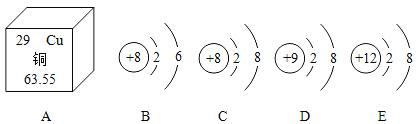
①铜的相对原子质量为______。
②以上五种粒子中,属于同种元素的粒子是______(填序号)。
③D与E形成的化合物可表示为______(用D、E表示)。
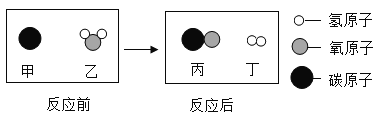
(2)下图为两种化合物在一定条件下发生反应的微观示意图:
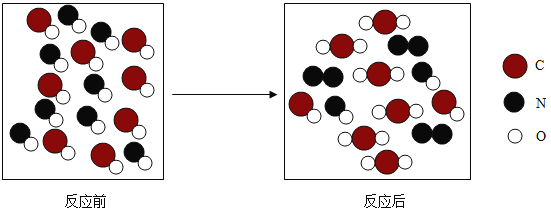
①写出该反应的化学方程式:______(不需要注明反应条件)。
②上述反应中,发生氧化反应的物质是______(填物质化学式);化合价降低的元素是______(填元素符号)。
【答案】63.55 BC ED2 2NO+2CO=N2+2CO2 CO N
【解析】
(1)①由元素周期表示意图可知,铜的相对原子质量为:63.55;
②属于同种元素的粒子是B和C,质子数都为8;
③D表示:氟离子(F-),E表示:镁离子(Mg2+),形成的化合物:ED2(MgF2);
(2)①由微观反应示意图可知:2NO+2CO=N2+2CO2;
②一氧化碳做还原剂,发生氧化反应,N(氮元素)由+2价变为0价。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目