题目内容
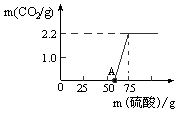
(5分)煤中一般都含有相当数量的硫,燃烧时会释放出二氧化硫,火力发电厂用石灰石浆吸收废气中的二氧化硫,以防止污染环境,其发生反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2。如果50 g废气中含有0.8 g二氧化硫,则处理1000 g这种废气需要含碳酸钙85%的石灰石多少克?
设碳酸钙的质量为X克,石灰石的质量为yg,50g废气中含有0.8g SO2,则1000 g这种废气中含有(1000X0.8/50)="16" g的SO2
2CaCO3 + 2SO2+ O2 = 2CaSO4 + 2CO2
2 2


 X/100 16/64
X/100 16/64
解方程组得X=25g,即碳酸钙的质量为25g。再由,(碳酸钙的质量/石灰石的质量)X100%=85%即:25/y="0.85" 解出y="29.5g"
2CaCO3 + 2SO2+ O2 = 2CaSO4 + 2CO2
2 2


 X/100 16/64
X/100 16/64解方程组得X=25g,即碳酸钙的质量为25g。再由,(碳酸钙的质量/石灰石的质量)X100%=85%即:25/y="0.85" 解出y="29.5g"

练习册系列答案
相关题目