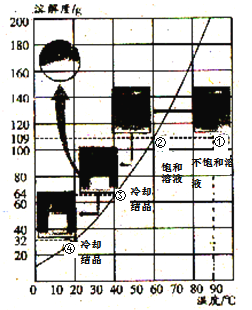
题目内容
【题目】化学实验小组同学将铁粉放入某硫酸铜溶液中时,发现生成红色固体物质的同时有较多的气泡放出。生成的是什么气体呢?同学们决定进行探究。探究前老师提示,该反应生成的气体只有一种。
(提出猜想)气体可能是SO2、O2或H2中的一种。
(查阅资料)SO2与二氧化碳化学性质相似,也能使澄清石灰水变浑浊。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,除了用带火星木条检验外,还可将气体通过灼热的铜网,如果观察到_____,证明猜想正确。
(2)乙同学认为是SO2,只需将气体通入澄清石灰水,看澄清石灰水是否变浑浊。写出SO2与Ca(OH)2反应的化学方程式_____。
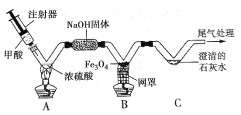
(3)实验小组同学综合考虑,设计了如图组合实验方案,验证猜想。
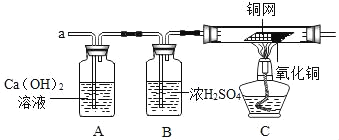
(实验探究)
(1)实验开始时,先将收集到的气体从a处通入一段时间后,再点燃C处酒精灯。这样操作的目的是_____。
(2)实验过程中发现A装置中溶液不变浑浊,C装置中黑色氧化铜变成光亮的红色物质__________。
(实验结论)铁粉与该硫酸铜溶液反应时,产生的气体是_____。
(思维拓展)
(1)硫酸铜溶于水时会有少量与水发生反应生成氢氧化铜而使溶液浑浊,为抑制该反应的发生,配制硫酸铜溶液时,通常先将硫酸铜溶解在少量物质X中,再加水稀释。上述实验中的气体就是铁与X反应产生的,你认为X最好是_____(写化学式)。
(2)如果将适量的铁粉放入某混有X的硫酸铜溶液时,铁粉恰好完全溶解,过滤得沉淀物,经洗涤干燥,称得沉淀物的质量与所加入的铁粉的质量相等。设与铁反应的CuSO4和X的质量分别为m1、m2,则m1:m2=_____。
【答案】铜网变黑色 Ca(OH)2+SO2═CaSO3↓+H2O 排出装置中的空气,防止发生爆炸 铜网不变色 氢气 H2SO4 80:7
【解析】
方案设计:
(1)氧气和铜能反应生成黑色氧化铜。甲同学认为是O2,除了用带火星木条检验外,还可将气体通过灼热的铜网,如果观察到铜网变黑色,证明猜想正确;
(2)SO2与Ca(OH)2反应生成亚硫酸钙和水,反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O;
实验探究:
(1)实验开始时,先将收集到的气体从a处通入一段时间后,再点燃C处酒精灯。气体中可能存在氢气,氢气不纯时加热可能发生爆炸。这样操作的目的是排出装置中的空气,防止发生爆炸;
(2)实验过程中发现A装置中溶液不变浑浊,说明气体不是二氧化硫,C装置中黑色氧化铜变成光亮的红色物质,说明氢气和氧化铜反应生成了铜,铜网不变色,说明气体不是氧气;
实验结论:
铁粉与该硫酸铜溶液反应时,产生的气体是氢气;
思维拓展:
(1)上述实验中的气体就是铁与X反应产生的,X最好是H2SO4,这是因为加入硫酸时,既能够防止产生沉淀,又不带入过多离子;
(2)铁和硫酸铜、硫酸反应的化学方程式及其质量关系为:
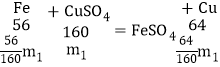
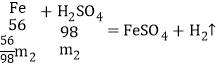
根据题意有:![]() ,则m1:m2=80:7。
,则m1:m2=80:7。

 初中暑期衔接系列答案
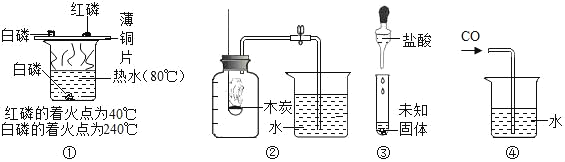
初中暑期衔接系列答案【题目】用如图所示装置,在常温下分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40 ℃。
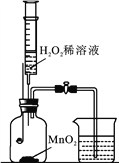
内容 | 【实验1】研究燃烧的条件 | 【实验2】研究氧气性质 |
Ⅰ | 烧杯中盛有80 ℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有氢氧化钠溶液,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为______________________。
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是________________________;推入H2O2溶液后,观察到烧杯中的现象是____________________________。
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是________;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶。该实验中,集气瓶内压强的变化过程是__________________________。