题目内容
【题目】取Cu-Zn合金10g,放入烧杯中,再向其中加入50g某稀盐酸恰好完全反应后,测得烧杯内剩余物质的质量共为59.8g 。
(1)生成氢气的质量为_______;所用稀盐酸的溶质质量分数是__________;
(2)该合金中锌的质量分数是多少_______?(写出计算过程)
【答案】0.2g 14.6% 65%
【解析】
根据质量守恒定律找出一种反应物或生成物的质量,然后根据化学方程式计算出需要的其它量,从而解决问题。
(1)铜-锌合金中铜不和稀盐酸反应,只有锌和稀盐酸反应生成氯化锌和氢气,反应前铜-锌合金和稀盐酸共(10g+50g)=60g,反应后剩余物质质量只有59.8g,根据质量守恒定律可知两者的差值就是生成的氢气质量,即生成氢气质量=(60g-59.8g)=0.2g,故填0.2g; 因为稀盐酸恰好完全反应,所以参加反应的HCl质量就是稀盐酸溶液中溶质质量,设稀盐酸中溶质HCl的质量为X,
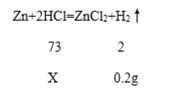
解得X=7.3g,所以稀盐酸中溶质质量分数=![]() =14.6%,故填14.6%;
=14.6%,故填14.6%;
(2)铜-锌合金中锌的质量分数=![]() ,所以要先算出原样品中锌的质量,根据化学方程式进行计算,设10.0g铜-锌合金样品中锌的质量为Y,
,所以要先算出原样品中锌的质量,根据化学方程式进行计算,设10.0g铜-锌合金样品中锌的质量为Y,
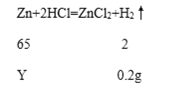
解得Y=6.5g,所以锌的质量分数=![]() =65%,故填65%。
=65%,故填65%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目