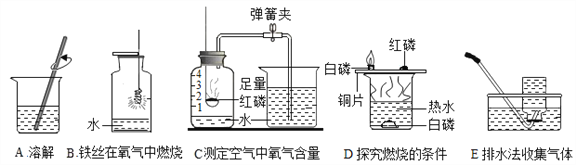
题目内容
【题目】铁是现代化学工业的基础,人类进步所必不可少的金属材料。
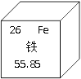
(1)如图为铁元素在元素周期表中的信息,亚铁离子(写出离子符号____)的核外电子数为___。
(2)健康人体内,总量4~5g的铁元素主要以____(选填“单质”、“化合物”)形式存在,缺铁会患上___(填字母)。
a.骨质疏松 b.甲状腺疾病 c.贫血症 d.侏儒症
(3)(实验一)
兴趣小组通过下图实验研究铁的冶炼
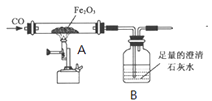
(资料1)已知铁的氧化物均能逐步失去其中的氧,最终被还原为铁。
![]()
(资料2)实验研究表明:该实验得到的是四氧化三铁与铁粉的混合物
①试写出一氧化碳和氧化铁在高温下生成铁的化学反应方程式_______;
②实验一段时间后,观察到A处现象是___; B处反应的方程式____;小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡。写出产生气泡反应的化学方程式___,说明黑色固体物质____(填字母)。
a.不含铁 b.一定全部是铁 c.含有铁
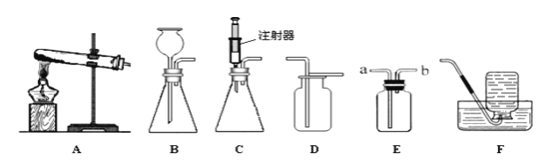
(4)(实验二)兴趣小组用下图实验研究实验一所得黑色粉末中单质铁的质量分数
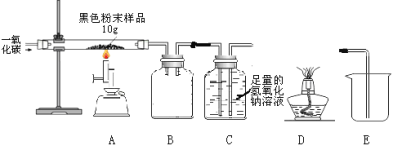
(资料3)氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,且吸收能力比石灰水强。
①从安全与规范的角度考虑,装置C后面应连接____(选填装置序号D或E),B装置的作用是_____。
②铁与四氧化三铁的混合物10 g充分反应后,玻璃管中剩余固体(单质铁)的质量为8.4g。请计算10 g黑色粉末中单质铁的质量分数______。
【答案】Fe2+ 24 化合物 C 3CO+Fe2O3=2Fe+3CO2 有黑色固体生成 CO2+Ca(OH)2=CaCO3↓+H2O Fe+H2SO4=FeSO4+H2↑ C E 防止倒吸 42%
【解析】
(1)铁原子失去两个电子形成了亚铁离子,离子符号为Fe2+,由铁元素在元素周期表中的信息可知,亚铁离子核外电子数为26-2=24;
(2)健康人体内:总量4~5g的铁元素主要以化合物形式存在,缺铁会患上贫血症;
(3)①一氧化碳和氧化铁在高温下生成铁和二氧化碳,化学的反应方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
②在A处有还原出的铁,所以实验一段时间后,观察到A处现象是有黑色固体生成;B处反应是A处生成二氧化碳与氢氧化钙反应生成了碳酸钙和水,方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡。产生气泡的反应是铁与稀硫酸反应生成了氢气,化学方程式是:Fe+H2SO4═FeSO4+H2↑,说明黑色固体物质是铁;
(4)①从安全与规范的角度考虑,装置C后面应连接E,来收集排出的氢氧化钠溶液,B装置的作用是防止倒吸;
②设四氧化三铁的质量为x,由四氧化三铁和一氧化碳反应的化学方程式可知固体减少的质量就是四氧化三铁中氧元素的质量可知:

![]()
x=5.8g,
则混合物中铁的质量分数为:![]() ×100%=42%。
×100%=42%。

 阅读快车系列答案
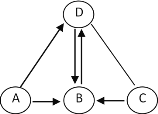
阅读快车系列答案【题目】一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2 | 8 | 30 | 50 |
反应后质量/g | 36 | 8 | 待测 | 22 |
(1)经计算待测数值为____________。
(2)该反应基本类型为 ___________。
(3)该实验中乙为该反应的催化剂,则在化学反应前后乙的______和 ________不发生改变。
(4)已知丙和丁的化学计量数之比是3:1,则丙和丁的相对分子质量之比为___________(填序号)。
A .1﹕14 B.3﹕14 C.12﹕11 D.3﹕5