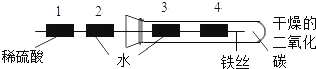
题目内容
【题目】小型化工厂常以纯碱和大理石为主要原料,按以下工艺流程生产烧碱(NaOH).
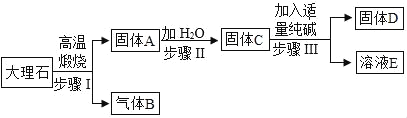
(1)物质C的化学式是_____没在步骤Ⅱ中要进行的分离操作是_____.
(2)写出步骤Ⅰ的化学方程式_____.
(3)写出步骤Ⅱ的化学方程式_____.
【答案】Ca(OH)2 过滤 CaCO3![]() CaO+CO2↑ CaO+H2O=Ca(OH)2
CaO+CO2↑ CaO+H2O=Ca(OH)2
【解析】
(1)贝壳的主要成分为CaCO3,碳酸钙在高温条件下生成氧化钙和二氧化碳,所以A为氧化钙,氧化钙和水反应会生成氢氧化钙,因此C是氢氧化钙;分离出固体和液体的方法为过滤;故填:Ca(OH)2;过滤;
(2)步骤Ⅰ发生的反应是碳酸钙在高温条件下生成氧化钙和二氧化碳,故化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(3)步骤Ⅱ发生的反应是氧化钙和水反应生成氢氧化钙,故化学方程式为:CaO+H2O=Ca(OH)2.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】黄铜是锌和铜的合金,可以用来制造机器零件及日常用品.为了测定某粉末状黄铜样品中锌的质量分数,取10g这种样品放入烧杯中,再将40g稀盐酸分四次加入到该烧杯中,均充分反应.测得的实验数据如下表:
实验次数 | 1 | 2 | 3 | 4 |
稀盐酸的用量 | 10g | 10g | 10g | 10g |
剩余固体的质量 | 8.7g | 7.4g | 6.7g | 6.7g |
分析表中数据,完成下列问题:
(1)在第_____次实验结束时样品中的锌就已完全反应.
(2)计算该黄铜样品中锌的质量分数_____.
(3)计算所用稀盐酸的溶质质量分数_____.
【题目】竹子是“有节、中空、四季常绿”的植物(如图1所示),同学们对竹子中的气体成分展开了探究,测定其成分。

图1
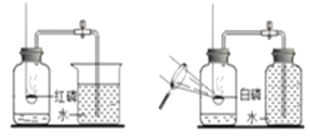
方案一 方案二
图2
(1)收集竹子中的气体。
小华提出:将一节竹子浸没在水中,在竹子上钻孔,用排水法收集气体。
小刚提出:可用注射器从竹子中抽取气体。
大家认为两人的想法都可行,于是分为A、B两组,在相同的条件下,A组采用小华的取气方法,B组采用小刚的取气方法,分别完成下面的实验。
(2)检验气体中是否含有二氧化碳气体。
实验步骤 | 实验现象 | 实验结论及解释 |
向所取气体中加入______ | _____ | 有二氧化碳。 |
(3)测定氧气含量。
(查阅资料)红磷的着火点为240℃,白磷的着火点为40℃。
(设计实验)同学们设计了如图2所示的方案一和方案二来测定氧气含量。
(进行实验)按上述两个方案进行多次实验。
a.实验中磷的量应为足量,原因是_____。
b.方案一中发生反应的化学方程式为_____。
(反思与评价)
c.经过A、B两组同学分别根据方案一、二实验,A组测得的含氧量总是大于B组的,你认为原因是_____。
注意:若答对以下两小题将奖励4分,但化学试卷总分不超过60分
(4)a.上述实验方案_____(填“能”或“不能”)准确测定竹节内氧气含量,为什么?_____。(每空1分)
b.为准确测定竹节中氧气的含量,同学们查阅资料,利用氧气传感器对实验做了改进(如图3所示),最终得到图4图象。
观察图4,你可以获得哪些信息:
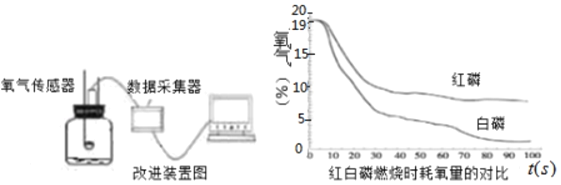
图3 图4
Ⅰ_____;Ⅱ_____。