��Ŀ����
����Ŀ����ͭ��п��ͭ�ĺϽ𣬿��������������������ճ���Ʒ��Ϊ�˲ⶨij��ĩ״��ͭ��Ʒ��п������������ȡ10g������Ʒ�����ձ��У��ٽ�40gϡ������Ĵμ��뵽���ձ��У�����ַ�Ӧ����õ�ʵ���������±���
ʵ����� | 1 | 2 | 3 | 4 |
ϡ��������� | 10g | 10g | 10g | 10g |
ʣ���������� | 8.7g | 7.4g | 6.7g | 6.7g |
�����������ݣ�����������⣺
��1���ڵ�_____��ʵ�����ʱ��Ʒ�е�п������ȫ��Ӧ��
��2������û�ͭ��Ʒ��п����������_____��
��3����������ϡ�����������������_____��
���𰸡�3 33% 14.6%
��������
���ݵ����κ͵��Ĵ�ʣ�����������ȿ�֪��ʣ���6.7g���弴Ϊ��Ʒ��ͭ���������ʵ�3��ʵ�����ʱ��Ʒ�е�п������ȫ��Ӧ���ɵ����κ͵��Ĵ�ʣ�����������ȿ�֪��ʣ���6.7g���弴Ϊ��Ʒ��ͭ����������п������Ϊ��Ʒ������ȥͭ���������ٸ���п����������Ʒ�����ȿɼ������ͭ��Ʒ��п���������������ݽ�����Կ�֪��ͭ�����������ϡ���ᷢ����Ӧ���ʷ�����Ӧ����п�����ٵĹ�����������Dzμӷ�Ӧ��п������������Ŀ��֪���ڶ��η�Ӧ����п��������8.7g��7.4g��1.3g�����ݷ�Ӧ�Ļ�ѧ����ʽ���ɼ��������10gϡ���������ʵ������������ʵ�����������ʽ���������ϡ���������ʵ�����������
��1���ɵ����κ͵��Ĵ�ʣ�����������ȿ�֪��ʣ���6.7g���弴Ϊ��Ʒ��ͭ���������ʵ�3��ʵ�����ʱ��Ʒ�е�п������ȫ��Ӧ��
��2���ɵ����κ͵��Ĵ�ʣ�����������ȿ�֪��ʣ���6.7g���弴Ϊ��Ʒ��ͭ����������п������Ϊ��Ʒ������ȥͭ����������Ϊ10g��6.7g��3.3g��
�ʻ�ͭ��п����������Ϊ��![]()
�𣺸û�ͭ��Ʒ��п����������33%��
��3�����ݽ�����Կ�֪��ͭ�����������ϡ���ᷢ����Ӧ���ʷ�����Ӧ����п�����ٵĹ�����������Dzμӷ�Ӧ��п������������Ŀ��֪���ڶ��η�Ӧ����п������Ϊ
8.7g��7.4g��1.3g
��ϡ���������ʵ�����Ϊx
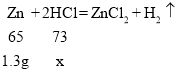
![]()
x��1.46g
ϡ���������ʵ���������Ϊ![]()
������ϡ�������������Ϊ14.6%��

 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�