题目内容
【题目】根据下图回答问题
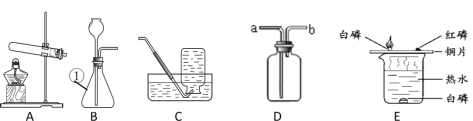
(1)仪器①的名称是__________。
(2)B与C连接制取气体,反应的化学方程式为________。
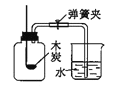
(3)实验室需少量甲烷气,可用加热无水醋酸钠与碱石灰的固体混合物制得。制甲烷气的发生装置应选用____(填字母)装置;收集甲烷气可选用C装置,由此推断甲烷气具有的物理性质是_______。
(4)用图D的装置排水法收集氧气。瓶中装入水的量应为___(选:“少量”、“多量”或“满瓶”),进气口为____(选“a”或“b”)。
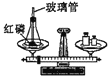
(5)E装置用来探究燃烧的条件,由铜片上白磷燃烧而红磷不燃烧得出的结论______。
(6)在实验室制取二氧化碳的研究中,进行了如下实验:
药品 | 甲 | 乙 | 丙 | 丁 |
大理石 | 2g,块状 | 2g,块状 | 2g,粉末状 | 2g,粉末状 |
盐酸(过量) | 20g,10%盐酸 | 20g,20%盐酸 | 20g,10%盐酸 | 20g,20%盐酸 |
Ⅰ、若要研究盐酸浓度大小对反应的影响,可选择实验甲与______对照(选填实验编号)。
Ⅱ、研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是_____(填字母序号)
①反应更为剧烈 ②最终剩余溶液的质量更小
③产生的二氧化碳的质量更大 ④粉末状大理石利用率更高
A.① B.①④ C.①③④ D.①②③④
【答案】锥形瓶 2H2O2 ![]() 2H2O +O2↑(或用金属与酸制取H2,合理答案即可) A 难溶于水 满瓶 b 可燃物温度要达到着火点 Ⅰ乙 ⅡA
2H2O +O2↑(或用金属与酸制取H2,合理答案即可) A 难溶于水 满瓶 b 可燃物温度要达到着火点 Ⅰ乙 ⅡA
【解析】
(1)仪器1的名称是锥形瓶。
(2)B装置是固液不加热型装置,C是排水法收集气体,故可以是过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,也可以是制取氢气等,故反应的方程式为:2H2O2 ![]() 2H2O +O2↑。
2H2O +O2↑。
(3)制甲烷气的反应物是固态,反应的条件是加热,故选固固加热型装置A。甲烷可以用排水法收集,说明甲烷难溶于水。
(4)图D是多功能瓶,改为排水法收集装置时,集气瓶中应该装满水,排尽瓶中的空气。由于气体的密度比水的密度小,故气体由短管b通入。
(5)铜片上的红磷和白磷都与氧气接触,但是温度达到了白磷的着火点,而没有达到红磷的着火点,白磷燃烧而红磷不燃烧,说明燃烧的条件之一是温度达到可燃物的着火点。
(6)Ⅰ根据控制变量法,若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙。
Ⅱ、①,丁实验中碳酸钙的质量相等,但是碳酸钙为粉末状,盐酸的浓度比甲实验中的大,故反应的速率更大,故正确。盐酸的浓度影响反应的速率,最终剩余溶液的质量相等,产生的二氧化碳的质量相等,故②③错误;④该反应中,大理石的形状不同,反应的速率不同,但是大理石的利用率相同,故错误。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】在一个密闭容器中放入A、B、C、D四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | A | B | C | D |
反应前质量 (g) | 9 | 2 | 22 | 1 |
反应后质量(g) | x | 2 | 6 | 21 |
(1)这一反应中 x=________g。
(2)写出一例与上述反应类型相同的化学方程式:_________。
【题目】学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:
实 验 | 一 | 二 | 三 | 四 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)上表中m的数值是________;
(2)反应中矿石有剩余是第_______次实验;
(3)这种石灰石矿中碳酸钙的相对分子质量是_______;
(4)15g碳酸钙中各元素质量比是_______;
(5)求稀盐酸中溶质的质量分数____。(写出计算过程)