题目内容
【题目】已知某种铸造钢轨的金属粉末原料中可能含有铁、锰、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究
(1)提出猜想:
猜想Ⅰ:该粉末由铜、锰组成
猜想Ⅱ:该粉末由铁、锰组成
猜想Ⅲ:1该粉末由铁、锰、铜组成
猜想Ⅳ:该粉末由____________组成。
(2)查阅资料:金属锰、铜不能被磁铁吸引,锰和硫酸亚铁溶液可以发生置换反应锰元素在生成物中显+2价,生成物的溶液为浅粉色。
(3)进行实验
实验目的 | 实验操作 | 实验现象 |
①证明粉末中是否含有铜 | 取一个小烧杯,加入适量的粉末,再向其中加入过量的___________。 | 有少量红色粉末不能溶解 |
②证明粉末中是否含有锰 | 取5.5g的粉末放入烧杯,再向其中加入过量的硫酸亚铁溶液,反应完全后过滤、干燥、称量固体为5.52g | _____ |
③证明粉末中是否含有铁 | 另取5.5g粉末___________(用物理方法),剩余金属粉末的质量为1.12g | _____ |
(4)初步结论:猜想_______成立,写出实验①中发生反应的一个化学反应方程式为_________________。
(5)数据处理:试计算粉末原料中任意一种金属所占的质量分数____________(用金属的名称和百分数表示,结果保留一位小数)。
【答案】铁和铜 稀盐酸或稀硫酸 浅绿色溶液变为浅粉色 用磁铁充分吸引 有大量黑色粉末被磁铁吸引 Ⅲ Fe+2HCl═FeCl2+H2↑或Mn+2HCl═MnCl2+H2↑(硫酸也给分) 铁 79.6%
【解析】
(1)从三种金属的组合对照已有的猜想可知,缺少铁和铜的组合,故答案为:铁和铜;
(3)铁和锰都能与酸反应,而铜不与酸反应,有红色粉末不溶解,说明物质中有铜.取5.5克粉末放入烧杯,再向其中加入适量的硫酸亚铁溶液,反应完全后过滤、干燥,称量固体为5.52克.反应前后固体质量增加了,只有锰能置换出硫酸亚铁中的铁,故粉末中一定有锰,看到的现象为浅绿色溶液变为浅粉色.铁能被磁铁吸引,取5.5克粉末,用磁铁充分吸引,称量剩余金属粉末为1.12克.说明物质中含有铁.
(4)初步结论:由以上实验可以得出物质中含有锰、铁、铜三种物质,与酸反应的化学方程式为:
Fe+2HCl═FeCl2+H2↑ Mn+2HCl═MnCl2+H2↑
(5)根据数据,总物质质量为:5.5g,其中铁粉5.5g-1.12g=4.38g,所以铁的质量分数=![]() ×100%=79.6%.设粉末中Mn的质量为x,则
×100%=79.6%.设粉末中Mn的质量为x,则
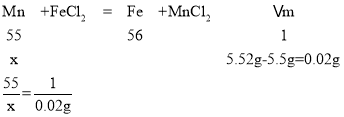
解得x=1.1g
所以锰的质量分数=![]() ×100%=20%,铜的质量分数=1-79.6%-20%=0.4%
×100%=20%,铜的质量分数=1-79.6%-20%=0.4%
故答案为:(1)铁和铜.
(3)进行实验:
实验目的 | 实验操作 | 实验现象 |
稀盐酸或稀硫酸 | ||
浅绿色溶液变为浅粉色 | ||
用磁铁充分吸引 | 有大量黑色粉末被磁铁吸引 |
(4)Ⅲ; Fe+2HCl═FeCl2+H2↑ Mn+2HCl═MnCl2+H2↑(硫酸也给分).
(5)铁 79.6%.

【题目】已知:CO2和SO2既有相似也有差异性。请回答相关问题:
气体 | CO2 | SO2 | |
制剂 | 石灰石与盐酸 | Na2SO3与70%硫酸 | |
相似性 | 溶解性 | 能溶于水 | 易溶于水 |
与澄清石灰水反应 | 二者都产生白色浑浊 | ||
差异性 | 与KMnO4溶液 | 不反应 | 气体被吸收,溶液逐渐褪色 |
(1)化石燃料燃烧气体产物中有CO2和SO2等物质,其中SO2是形成_______(填一污染名称)的主要物质。
(2)实验室制取CO2的化学方程式是________,可用于收集CO2的装置是_______(选填下图序号)。
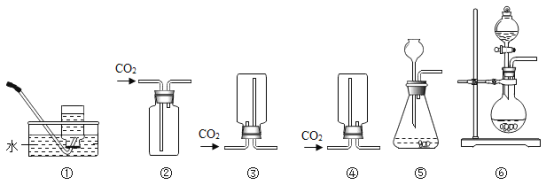
(3)将收集满SO2的试管倒扣在水中观察到的现象是_______。
(4)结合已知信息,请你设计实验证明化石燃料燃烧的气体产物中有CO2(写出操作、试剂、现象、结论)。________
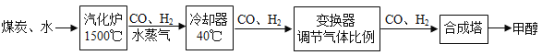
(5)二氧化碳是一种宝贵的碳氧资源。一定条件下,二氧化碳转变成燃料甲醇(CH3OH)的化学式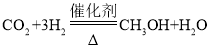 。若生产64t甲醇,则可回收二氧化碳多少吨?_____
。若生产64t甲醇,则可回收二氧化碳多少吨?_____
【题目】人类的生产生活离不开金属材料
(1)人类历史上金属大规模开发、利用的先后顺序与多种因素有关,请列举一条相关的因素_____。
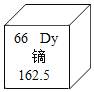
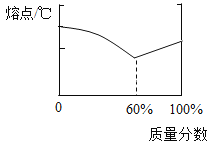
(2)下表示一些金属的熔点数据:
金属 | 铅 | 锡 |
熔点/℃ | 327.5 | 231.9 |
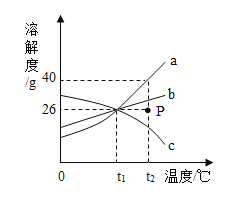
锡铅合金中某种金属的质量分数与合金熔点有如图所示的关系。当合金熔点最低时,合金中锡与铅的质量比是_____。
(3)如下图所示,为实验室中常见的气体制取和收集装置:
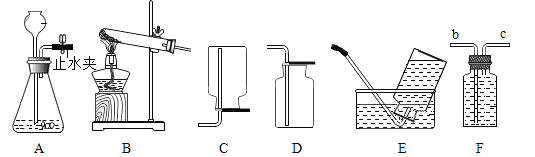
①检查A装置气密性的方法是夹紧止水夹,_____,则气密性良好。
②实验室用金属锌和稀硫酸可以制取氢气,如果想得到较干燥的氢气,可选用的一套制取装置为_____,反应的化学方程式为_____。若采用F装置来收集氢气,氢气应从_____通入(选填b或c)。
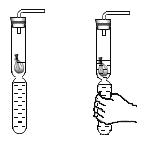
③课外小实验中,小明同学利用废弃的“棒棒冰”塑料为材料制成了如图所示的气体发生装置。该装置与A装置相比的优点有哪些_____(写出一点即可)
(4)某兴趣小组利用废铁屑与废硫酸起反应来制取硫酸亚铁(只考虑铁与酸的反应)他们将6g废铁屑放入烧杯中,缓慢加入废硫酸直至不再产生气泡。发现加入废硫酸的质量为98g,最后称得称量烧杯的总质量为103.8g(不含烧杯的质量)。试求制取硫酸亚铁的质量为多少_____?