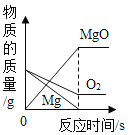
题目内容
【题目】如图为a、b、c三种不含结晶水的固体物质的溶解度曲线,下列叙述中正确的是
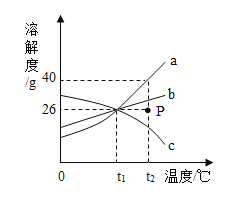
A.t1℃时,a、b、c饱和溶液的溶质质量分数约为21%
B.P点表示t2℃时,a、b的溶液是饱和状态,c的溶液是不饱和状态
C.t2℃时,a、b、c三种物质溶液的溶质质量分数a>b>c
D.100ga溶液从t2℃降温到t1℃时,析出晶体14g
【答案】A
【解析】
A、因为该温度下,它们有交点,溶解度相同,t1℃时,a、b、c饱和溶液的溶质质量分数为:![]() ,故选项正确;
,故选项正确;
B、P点在ab曲线的下方,在c曲线的上方,则P点表示,t2℃时,表示a、b的不饱和溶液,c的饱和溶液,故选项错误;
C、t2℃时,因为没有指明是饱和溶液,不能比较三种溶液的质量分数;故选项错误;
D、没有说明该溶液是否为饱和溶液,不能确定析出固体的质量,故选项错误;
故选:A。

【题目】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
(1)提出问题:这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
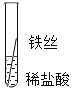
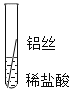
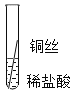
(2)实验探究:同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格将粗细相同的铁丝、铝丝、铜丝分别插人体积相同、溶质质量分数也相冋的稀盐酸中:
操作 |
|
|
| 根据现象得出金属活动性顺序 |
片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al, Fe>Cu |
几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 | _____ |
(3)讨论交流:为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
(4)反思评价:做金属性质实验时需将金属进行打磨,打磨的目的是_____。
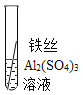
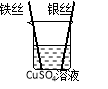
(5)实验验证:为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作 |
|
| 根据现象得出金属活动性顺序 |
现象 | 无明显现象 | _____ | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学反应方程式_____。
(6)拓展迁移:若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为_____。
【题目】已知某种铸造钢轨的金属粉末原料中可能含有铁、锰、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究
(1)提出猜想:
猜想Ⅰ:该粉末由铜、锰组成
猜想Ⅱ:该粉末由铁、锰组成
猜想Ⅲ:1该粉末由铁、锰、铜组成
猜想Ⅳ:该粉末由____________组成。
(2)查阅资料:金属锰、铜不能被磁铁吸引,锰和硫酸亚铁溶液可以发生置换反应锰元素在生成物中显+2价,生成物的溶液为浅粉色。
(3)进行实验
实验目的 | 实验操作 | 实验现象 |
①证明粉末中是否含有铜 | 取一个小烧杯,加入适量的粉末,再向其中加入过量的___________。 | 有少量红色粉末不能溶解 |
②证明粉末中是否含有锰 | 取5.5g的粉末放入烧杯,再向其中加入过量的硫酸亚铁溶液,反应完全后过滤、干燥、称量固体为5.52g | _____ |
③证明粉末中是否含有铁 | 另取5.5g粉末___________(用物理方法),剩余金属粉末的质量为1.12g | _____ |
(4)初步结论:猜想_______成立,写出实验①中发生反应的一个化学反应方程式为_________________。
(5)数据处理:试计算粉末原料中任意一种金属所占的质量分数____________(用金属的名称和百分数表示,结果保留一位小数)。