题目内容
【题目】科学家正在研究如下图所示的工艺流程来实现对二氧化碳处理。

(1)从图中分析得出的下列结论中,正确的是_______(填字母序号)。
A.二氧化碳也是一种重要的资源
B.利用降温、加压将二氧化碳分离是化学变化
C.二氧化碳与氢气在复合催化剂下反应产物是混合物
D.液化石油气、汽油、甲醇等物质燃烧都有二氧化碳产生
(2)已知甲醇的化学式为CH3OH在氧气中完全燃烧生成二氧化碳和水,请写出该反应的化学方程式为______________。
(3)“绿色化学”的特点之一是“零排放”。一定条件下,一氧化碳和氢气可以按照不同比例反应,若只生成一种产物就能实现“零排放”,符合这一要求的产物是_____________(填字母序号)。
A.甲醇(CH4O) B.甲醛(CH2O)C.乙醇(C2H6O) D.乙醛(C2H4O)E.乙酸(C2H4O2)
(4)该流程中可以循环利用的物质是_______,这样做有利于_____________。
【答案】ACD 2CH3OH+3O2 ![]() 2CO2+4H2O ABE CO2 缓解温室效应
2CO2+4H2O ABE CO2 缓解温室效应
【解析】
(1)A、从图中可知二氧化碳可用于制备汽油、甲醇等,二氧化碳是一种重要的资源,故正确;
B、利用降温、加压将二氧化碳分离属于物理变化,故错误;
C、二氧化碳与氢气在复合催化剂下反应产物有液化石油气、汽油、甲醇等,是混合物,故正确;
D、液化石油气、汽油、甲醇等物质都含有碳元素,燃烧都有二氧化碳产生,故正确。故填:ACD;
(2)甲醇完全燃烧时,生成二氧化碳和水,反应方程式是:2CH3OH+3O2 ![]() 2CO2+4H2O;
2CO2+4H2O;
(3)根据“一氧化碳和氢气反应,只生成一种产物”可判断所生成的有机物中C、O元素的原子个数比应与CO中C、O元素的原子个数相同为1:1;根据所生成有机物中C、O元素的原子个数比,
A、根据化学式CH4O,可知该物质中C、O元素的原子个数比为1:1,符合所生成有机物的特点,故正确;
B、根据化学式CH2O,可知该物质中C、O元素的原子个数比为1:1,符合所生成有机物的特点,故正确;
C、根据化学式C2H6O,可知该物质中C、O元素的原子个数比为2:1,不符合所生成有机物的特点,故错误;
D、根据化学式C2H4O,可知该物质中C、O元素的原子个数比为2:1,不符合所生成有机物的特点,故错误;
E、根据化学式C2H4O2,可知该物质中C、O元素的原子个数比为1:1,符合所生成有机物的特点,故正确。故选ABE;
(4)由流程可知,该流程中可以循环利用的物质是CO2;由于空气中二氧化碳增多,会引起温室效应,这样做有利于缓解温室效应。

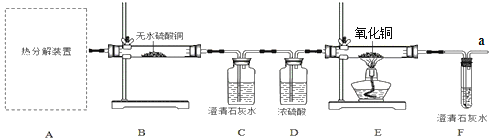
【题目】根据下列实验装置图,回答有关问题。
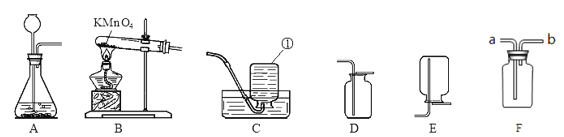
(1)图中标有①的仪器名称是______________。
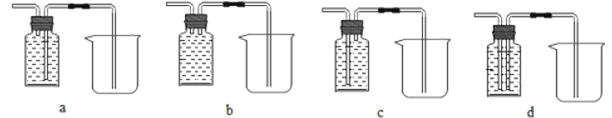
(2)实验室制取氢气应选择的发生装置是__________,若要获得较纯净的氢气,应选择的收集装置是__________。为保证安全,点燃氢气前,应进行的操作是_____________。
(3)实验室利用过氧化氢溶液和二氧化锰制氧气,反应的化学方程式为__;若用B装置作制氧气的发生装置,应进行的改进是__________;反应的化学方程式为_________;若用装置F收集氧气,则气体应从导管_______(填“a”或者“b”)端通入;实验结束时应先移出导管再熄灭酒精灯,若操作顺序相反,则可能造成___________。
(4)排水法收集与排空气法收集二氧化碳的比较(分别用体积相同的两个集气瓶收集)
已知:CO2+H2O+CaCO3==Ca(HCO3)2,Ca(HCO3)2能溶于水。
比较项目 | 排水法 | 向上排空气法 |
收集方法可行性分析 | 因为CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率,所以可以用排水法收集 | 因为________,所以可用向上排空气法收集 |
收集过程分析 | 集满现象:____________ | “验满”因气体无色,故集满与否较难确定,即便用燃着的木条移近容器口火焰熄灭,也难以证明空气完全排尽 |
向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后澄清所需时间较短 | 先浑浊后澄清所需时间较长 |
由上述实验可得结论 | 与排空气法相比,排水法的优点是__________ | |
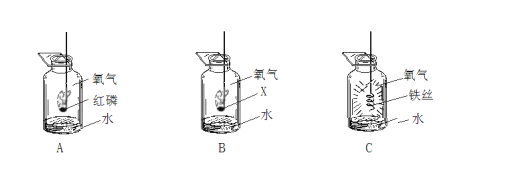
【题目】密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是( )
物质 | X | O2 | CO2 | H2O |
反应前质量/g | 16 | 70 | 1 | 0 |
反应后质量/g | 0 | 待测 | 45 | 36 |
A. 该反应为分解反应 B. 反应生成的CO2和H2O的质量比为45:36
C. 表中“待测”值为5 D. X中一定含有碳、氢两种元素