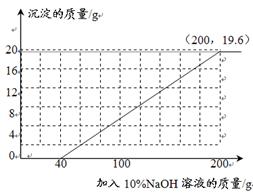
题目内容
用KClO3和MnO2的混合物100克制取氧气,反应前测得MnO2占混合物总质量的25%,反应一段时间后,又测得MnO2占30%。求:此时分解的KClO3的质量是多少?制得的氧气的质量是多少?
用100克KClO3和MnO2的混合物制取氧气,反应前测得MnO2占混合物总质量的25%,反应一段时间后,又测得MnO2占30%。求:此时分解的KClO3的质量是多少?制得的氧气的质量是多少?
思路解析:反应前:
MnO2的质量为:100克×25%=25克
KClO3的质量为:100克-25克=75克
反应后:
混合物的质量为:25克÷30%=83.3克
生成氧气的质量为:100克-83.3克=16.7克
设已分解的KClO3的质量为x。
2KClO3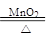 2KCl+3O2↑
2KCl+3O2↑
245 96
x 16.7克
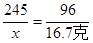
x=42.6克
答案:分解的KClO3的质量为42.6克,制得氧气16.7克。
思路解析:反应前:
MnO2的质量为:100克×25%=25克
KClO3的质量为:100克-25克=75克
反应后:
混合物的质量为:25克÷30%=83.3克
生成氧气的质量为:100克-83.3克=16.7克
设已分解的KClO3的质量为x。
2KClO3
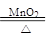 2KCl+3O2↑
2KCl+3O2↑245 96
x 16.7克
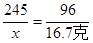
x=42.6克
答案:分解的KClO3的质量为42.6克,制得氧气16.7克。
试题分析:反应前:
MnO2的质量为:100克×25%=25克
KClO3的质量为:100克-25克=75克
反应后:
混合物的质量为:25克÷30%=83.3克
生成氧气的质量为:100克-83.3克=16.7克
设已分解的KClO3的质量为x。
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
x 16.7克
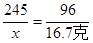
x=42.6克
答:分解的KClO3的质量为42.6克,制得氧气16.7克。
点评:催化剂在化学反应前后的质量和化学性质不变;根据化学方程式计算时,要注意解题的步骤,即:设、写、找、列、解、答。

练习册系列答案
相关题目