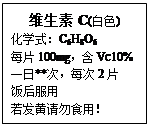题目内容
50 g镁、锌、铁的混合物与足量的稀硫酸反应,将混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为
| A.1 g | B.2 g | C.3 g | D.4 g |
B
试题分析:三种金属与硫酸反应的结果是:Mg→MgSO4; Zn→ZnSO4; Fe→FeSO4。这个变化中,最终所得的固体的质量,比混合金属增加的质量,就是硫酸根的质量:146g-50g=96g,而氢气的质量都来自于反应掉的硫酸中氢元素的质量,在H2SO4中氢元素与硫酸根的质量比为2:96;设该硫酸中硫酸根的质量为x,则有
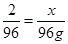 ;x=2g;选B。
;x=2g;选B。点评:解答本题,要充分分析化学反应的过程和本质,知道最终所得固体增加的质量是金属与硫酸根质量的总和,然后还要想到,硫酸中的氢元素与硫酸根的质量比为2:96才行,难度较大。

练习册系列答案
相关题目
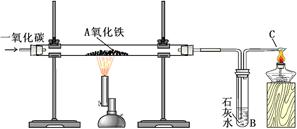
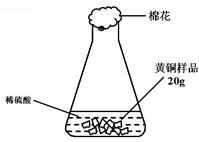
 2NaOH + Cl2↑+ H2↑
2NaOH + Cl2↑+ H2↑  Na2CO3+H2O
Na2CO3+H2O