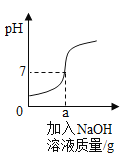
题目内容
【题目】某化学兴趣小组的同学做完“大理石和稀盐酸制取二氧化碳的实验”后,将反应后锥形瓶中残留的废液过滤,并对滤液进行探究(已知大理石中所含杂质既不溶于水,也不与酸反应)。
(提出问题)滤液中所含溶质是什么?
(查阅资料)氯化钙溶液呈中性
(猜想与假设)
猜想1:滤液中的溶质可能是CaCl2和CaCO3
猜想2:滤液中的溶质只有CaCl2
猜想3:滤液中的溶质是_______。
(讨论与交流)
小明认为猜想1无需验证就知道是错误的,他的理由是__________。
(实验与结论)
(1)小亮同学为验证猜想2,取少量滤液装入试管中,然后滴入酚酞溶液,发现酚酞溶液不变色,于是小亮认为猜想2正确。你认为他的结论_______(填“正确”或“错误”),理由是_______。
(2)小美为验证猜想3,用洁净干燥的玻璃棒蘸取该滤液滴到湿润的pH试纸上,测得pH=4,她认为猜想3正确。对她的操作方法、测量结果及结论的评价,正确的是______。
A.方法不正确,结果偏小,结论正确 B.方法正确,结果偏大,结论不正确
C.方法不正确,结果偏大,结论正确 D.方法正确,结果偏小,结论不正确
(3)小丽使用了几种物质类别不同的物质来验证猜想3,也得出了结论,请完成下表:
方案 | 使用的试剂 | 实验现象 | 结论 |
A | 石蕊溶液 | 溶液变红 | 猜想3正确 |
B | 镁条 | __________ | |
C | 氧化铁 | _________ | |
D | _____ | 固体溶解,溶液变成蓝色 | |
E | 硝酸银溶液 | 产生白色沉淀 |
(反思与评价)上述方案有错误及错误的原因是________、___________(填写错误方案的序号,并解释其错误的原因)。
(拓展与延伸)若猜想3成立,小聪认为无需另加试剂,只要对滤液进行_______操作即可除去杂质,得到CaCl2固体。
(4)小明同学向一定质量的上述猜想3滤液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。问:
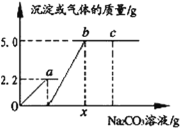
①图中oa段表示生成_______(“气体”还是“沉淀”)的过程;
②a点溶液中溶质为_________;
③c点溶液的pH_____7(填>、<、=);
④x值是_________?(写出具体的计算过程)
【答案】 HCl、CaCl2 CaCO3难溶于水 错误 溶液中的溶质是CaCl2和HCl时,滴加酚酞溶液也不变色 C 镁条溶解,有气体产生 固体溶解,溶液变成棕黄色 氢氧化铜 E 若只有CaCl2时,加硝酸银也会产生白色沉淀 蒸发 气体 氯化钠、氯化钙 pH>7 106g
【解析】本题考查了实验探究物质的组成成分,溶液的酸碱度测定,有关溶质质量分数的简单计算,盐的化学性质等。综合性较强,解题根据各种物质的性质,结合各方面条件进行分析、判断得出正确的结论。
猜想与假设:大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,当恰好完全反应时,滤液中的溶质是氯化钙,当盐酸过量时,滤液中的溶质是氯化氢和氯化钙,根据前面的猜想,可以考虑盐酸有剩余,废液中含有HCl、CaCl2;
讨论与交流:CaCO3难溶于水,不可能在溶液中;
实验与结论:
(1)小亮同学为验证猜想2:其结论错误,酚酞的变色范围是:酸性、中性不变色,碱性为红色,溶液中的溶质是CaCl2和HCl时,滴加酚酞溶液也不变色;
(2)测定溶液的pH,试纸不能湿润,所以操作方法不正确,溶液滴到“湿润”的pH试纸上,溶液被稀释,溶液的酸性减弱,pH变大,所以结果偏大,酸性溶液稀释后溶液仍呈酸性,所以结论正确;故选C;
(3)B、若猜想3正确溶液中存在盐酸,金属镁会与盐酸反应生成可溶的氯化镁和氢气,所以实验现象是镁溶解,有气体产生;
C、若猜想3正确溶液中存在盐酸,氧化铁会与盐酸反应生成可溶的氯化铁和水,所以实验现象固体溶解,溶液变成棕黄色;
D、根据“小丽使用了几种物质类别不同的物质来验证猜想3”的信息结合已用的试剂的种类可知D是一种碱,滤液中加入D后产生了固体溶解,溶液变成蓝色,则D是氢氧化铜;
反思与评价:氯化钙和氯化氢都能使硝酸银产生不溶于稀硝酸的白色沉淀。若只有CaCl2时,加硝酸银也会产生白色沉淀,所以方案E错误;
拓展与应用:氯化氢是气体溶质,受热后能从溶液中挥发出来。只要对滤液进行蒸发操作即可除去杂质,得到CaCl2固体;
(4)①碳酸钠先与盐酸反应,再与氯化钙反应,首先反应的方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,所以图中oa段表示生成气体的过程;
②a点表示Na2CO3恰好与盐酸反应,溶液中含有氯化钠、氯化钙两种溶质;
③c点时,碳酸钠已经过量,碳酸钠溶液呈碱性,c点溶液的pH>7;
④根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,设;生成2.2g二氧化碳需碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑;
106 44
x 2.2g
![]() x=5.3g
x=5.3g
设:生:5.0g碳酸钙需碳酸钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
y 5.0g
![]() y=5.3g
y=5.3g
x的值是碳酸钠溶液与混合溶液恰好完全反应消耗的碳酸钠溶液的质量。所以x=![]() =106g。
=106g。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案