题目内容
【题目】某课外兴趣小组的同学绘制四种实验操作的变化趋势图像,其中正确的是
A. 某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.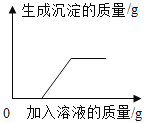 向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液
向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液
C.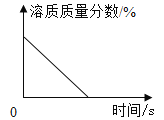 浓硫酸长期露置在空气中
浓硫酸长期露置在空气中
D.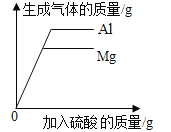 向等质量的金属镁和铝中分别加入足量且质量分数相等的稀硫酸
向等质量的金属镁和铝中分别加入足量且质量分数相等的稀硫酸
【答案】BD
【解析】
A、向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,硝酸钾会继续溶解,溶质质量分数不断增大,待硝酸钾溶液达到饱和后,,因为温度一定,溶质质量分数不再变化,所以A错误;
B、向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液,加入的氢氧化钠会先与硫酸反应,当硫酸完全反应后,才能与硫酸铜反应生成氢氧化铜沉淀,所以,开始时加入氢氧化钠,并没有沉淀生成,后来才有沉淀生成。故B选项正确;
C、浓硫酸长期露置在空气中,由于浓硫酸具有吸水性,浓硫酸可以吸收空气中的水分,溶液被稀释,溶质的质量分数降低。然而当质量分数降低到一定程度时,就会变成稀硫酸,无法再吸收空气中的水分,因此溶质的质量分数不能下降至0,故C选项错误;
D、当滴加的质量分数相等的稀硫酸的量不足时,酸会完全反应掉,由于氢气来自于酸,故相等量的酸完全反应所产生的氢气的量相等,当硫酸过量时,相同质量的镁和铝都会完全反应,镁与稀硫酸反应:![]() ,铝与稀硫酸反应:
,铝与稀硫酸反应:![]() ,而根据化学方程式的计算可知,等质量的镁、铝与足量的酸完全反应时,铝产生的氢气较多,故D正确。
,而根据化学方程式的计算可知,等质量的镁、铝与足量的酸完全反应时,铝产生的氢气较多,故D正确。
故本题选BD。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
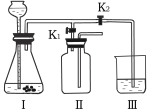
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】酸有相似的化学性质,碱也有相似的化学性质,当将氢氧化钠溶液和稀盐酸混合时,却没有看到明显现象。
[提出问题]氢氧化钠溶液与稀盐酸是否发生化学反应?
[查阅资料] 酸与碱发生中和反应会放出热量。
[实验设计] 甲、乙、丙三位同学分别设计了实验方案,请你帮他们完成实验报告。
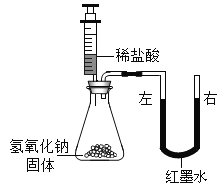
同学 | 实验操作 | 现象 |
甲 | 将稀盐酸慢慢滴入加有酚酞的NaOH 溶液中,并不断搅拌 | 溶液颜色的变化是_________ |
乙 |
| U型玻璃管中__________边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
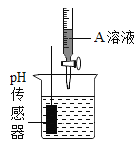
丙 | 用pH传感器测量反应过程中溶液pH值的变化情况 。 | 实验过程中, 不断搅拌得到的烧杯中溶液PH值变化曲线。
|
[结论]氢氧化钠与稀盐酸发生了化学反应。
(1) 氢氧化钠与盐酸反应的化学方程式为_______________________。
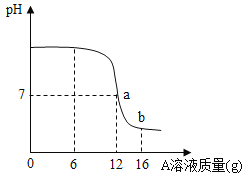
(2) 丙同学实验中,根据pH曲线判断,当加入A溶液____(填名称) 的质量为_______________g时, 反应恰好完全进行。
(3)丙同学实验中,当加入l6g A溶液时,烧杯中溶液的溶质是_______________________。
[反思]后来,同学们一致认为乙方案不够合理,理由是_______________________。
【题目】甲和乙的溶解度(见下表)及溶解度曲线(如下图)。下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | 甲 | 26.3 | 28.2 | 31.4 | 31.4 | 30.0 | 28.2 |
乙 | 30.6 | 28.2 | 26.8 | 31.4 | 37.5 | 42.0 | |
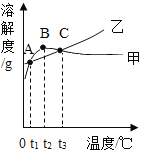
A.甲、乙为易溶物质
B.t2值介于20~40℃
C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D.等质量的甲,乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,继续添加的甲、乙固体质量相等