题目内容
【题目】向盛有25g纯碱样品(含有少量氯化钠)的烧杯中加入100g水使其完全溶解,再加入95g过量的氯化钙溶液,充分反应后,过滤、洗涤、干燥得到沉淀20g。试计算:(已知反应的化学方程式Na2CO3+CaCl2=2NaCl+CaCO3↓)
(1)样品中纯碱的质量分数。
(2)计算反应后所得溶液的溶质质量分数。(写出计算过程,结果保留到0.1%)
【答案】(1)84.8%(2)13.6%
【解析】
根据化学方程式的计算,利用沉淀20g,可以求出Na2CO3和生成的NaCl的质量;由于样品中含有NaCl,所以反应后氯化钠的总质量是原有的加生成的,反应后的溶液质量是所有物质相加减去沉淀的质量,最后计算作答。
解:设碳酸钠的质量为x,生成的氯化钠的质量为y。
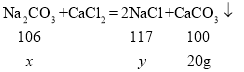
![]() ,解得
,解得![]() 21.2g;
21.2g;
![]() ,解得
,解得![]() 23.4g;
23.4g;
样品中纯碱的质量分数= ![]()
反应后氯化钠的总质量=25g-21.2g+23.4g=27.2g
反应后所得溶液中氯化钠的溶质质量分数:![]()
答:样品中纯碱的质量分数是84.8%,反应后所得溶液中氯化钠的溶质质量分数是13.6%。

练习册系列答案
相关题目