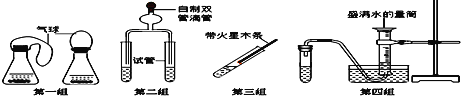
��Ŀ����
����Ŀ���˵����Ϊ1��18��Ԫ�ص�ԭ�ӽṹʾ��ͼ����Ϣ��ͼ���ش���������;
��1��������ѧ��______������Ԫ�������ɲ����Ƴ�Ԫ�����ڱ���
��2���ڵ��������У���ԭ�ӽṹ�Ĺ�֮ͬ����______________���������У���ԭ�Ӻ�������Ų��ı仯������__________________ ��
��3���ڵ��������У�Ԫ�����͵ı仯����ǣ���������____Ԫ�����ɵ�____Ԫ�أ�����ϡ�������β��
��4��д����������Ų�����ԭ����ͬ�������Ӻ������ӷ��Ÿ�һ����������______��������_________��
���𰸡��Ž��з���Ӳ�����ͬ�������������ε�����������������1������Ԫ�طǽ���Ԫ��Na+ (��Mg2+���� A13+ )F- ���� O2-��
��������
��1��1869�꣬������ѧ���Ž��з�����Ԫ�������ɲ����Ƴ�Ԫ�����ڱ���
��2���ڵ��������У���ԭ�ӽṹ�Ĺ�֮ͬ����ԭ�Ӻ�����Ӳ�����ͬ���������У������ң���ԭ�Ӻ�������Ų��ı仯�����������������������ӣ�
��3���ڵ��������У�Ԫ�����͵ı仯����ǣ��������ɽ���Ԫ�ع��ɵ��ǽ���Ԫ�أ�����ϡ������Ԫ�ؽ�����
��4����������Ų�������ԭ����ͬ�������ӿ����������ӻ�þ�����Լ������ӣ����ӷ��ŷֱ�ΪNa+��Mg2+��Al3+���������з����ӡ������ӣ����ӷ��ŷֱ�ΪF-��O2-��

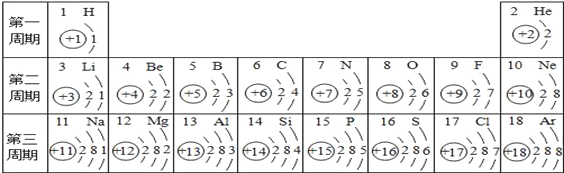
����Ŀ��Ԫ����������ѧϰ���о���ѧ����Ҫ���ߡ��±���Ԫ�����ڱ��IJ�����Ϣ��
1��H �� | 2��He �� | |||||||
3��Li � | 4��Be �� | 5��B �� | 6��C ̼ | 7��N �� | 8��O �� | 9��F �� | 10��Ne �� | |
12��Mg þ | 13��A1 �� | 14��Si �� | 15��P �� | 16��S �� | X��C1 �� | 18��Ar � | ||
19��K �� | 20��Ca �� | ���� | ||||||
���������Ϣ���ش�
��1���ؿ��к�������Ԫ�ص�ԭ��������_______ ��
��2�������ϱ����ɣ�����֪������X =________��
��3��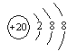 ��ʾ���ǣ�д���ӷ��ţ�_______��
��ʾ���ǣ�д���ӷ��ţ�_______��