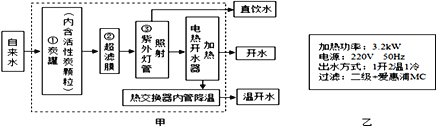
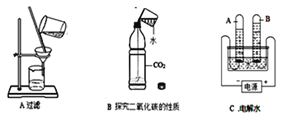
题目内容
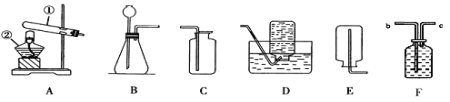
【题目】根据下图所示实验,并阅读小资料,回答下列问题。
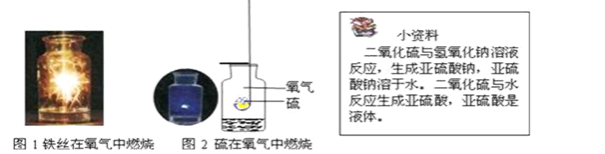
(1)图1中反应的文字表达式___________,集气瓶中加入水的作用是__________。
(2)图2中反应的文字表达式为______,集气瓶中加入的液体可能________,其目的为_____________________。硫在空气中燃烧,不如在氧气中燃烧剧烈的原因是_____________。
【答案】铁+氧气![]() 四氧化三铁防止高温熔融物溅落下来使瓶底炸裂硫+氧气
四氧化三铁防止高温熔融物溅落下来使瓶底炸裂硫+氧气![]() 二氧化硫水或氢氧化钠溶液吸收有毒的SO2气体防止空气污染空气中氧气浓度低
二氧化硫水或氢氧化钠溶液吸收有毒的SO2气体防止空气污染空气中氧气浓度低
【解析】
(1)铁在氧气中燃烧生成四氧化三铁,反应的文字表达式:铁+氧气![]() 四氧化三铁;集气瓶底部加入水是防止高温熔融物溅落下来使瓶底炸裂;
四氧化三铁;集气瓶底部加入水是防止高温熔融物溅落下来使瓶底炸裂;
(2)硫在氧气中燃烧生成二氧化硫反应的文字表达式:硫+氧气![]() 二氧化硫;根据资料可知:集气瓶中加入的液体可能是水或氢氧化钠溶液;其目的是为了吸收二氧化硫,防止空气污染 ;硫在空气中燃烧不如在氧气中燃烧剧烈,原因是空气中还含有其它气体,氧气浓度偏低。
二氧化硫;根据资料可知:集气瓶中加入的液体可能是水或氢氧化钠溶液;其目的是为了吸收二氧化硫,防止空气污染 ;硫在空气中燃烧不如在氧气中燃烧剧烈,原因是空气中还含有其它气体,氧气浓度偏低。

【题目】元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
1 H 氢 | 2 He 氦 | |||||||
3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | |
12 Mg 镁 | 13 A1 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | X C1 氯 | 18 Ar 氩 | ||
19 K 钾 | 20 Ca 钙 | …… | ||||||
认真分析信息,回答:
(1)地壳中含量最多的元素的原子序数是_______ ;
(2)分析上表规律,可推知,表中X =________;
(3)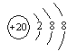 表示的是(写粒子符号)_______;
表示的是(写粒子符号)_______;
【题目】小明对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他把纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录。请你分析回答:
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时的现象 | 剧烈燃烧, 无火星。 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | A_____ |
(1) 表中“A”处内容应为 ___________________。
(2)镁条燃烧的化学式表达式为__________________________。
(3)通过以上探究,你认为铁丝燃烧产生火星四射现象的原因可能是__________________;实验时,铁丝需绕成螺旋状的目的是______________________,为防止瓶底炸裂,需__________,铁丝燃烧的化学式表达式为____________________________________。
(4)铁除了可以在氧气中燃烧,还可以在空气中发生缓慢氧化,该过程 _________(填“放热”或“吸热”);在生活中缓慢氧化的例子很多,下列也属于缓慢氧化的是____(填序号)。
①锅炉爆炸 ②动植物的呼吸 ③食物的腐烂 ④水结成冰 ⑤酒和醋的酿造 ⑥农家肥的腐熟 ⑦火药爆炸
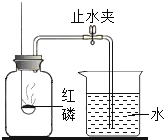
(5)某同学利用铁粉来测定空气中氧气的含量,如图所示,将足量的铁粉用水均匀地粘在试管内壁上,将试管倒立在装有水的烧杯中。实验过程中,观察到试管内液面缓慢上升。下列分析错误的是(______)
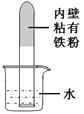
A.水能进入试管的最大体积为试管容积的1/5
B.该铁粉在试管内发生了氧化反应
C.这一实验可以验证空气的组成不是单一的
D.如果把铁粉改为木炭粉,两者的现象完全相同