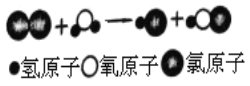
题目内容
【题目】下列化学方程式中符合题意且书写正确的是( )
A. 生活中用天然气作燃料:C2H3OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
B. 工业上用熟石灰制取烧碱:Ca(OH)2+2NaNO3═Ca(NO3)2+2NaOH
C. 用小苏打治疗胃酸过多症:Na2CO3+2HCl═2NaCl+CO2↑+H2O
D. 正常雨水偏弱酸性原因:CO2+H2O═H2CO3
【答案】D
【解析】A、天然气的主要成分是甲烷,燃烧的化学方程式为:C2H3OH+3O2![]() 2CO2+3H2O,错误;B、工业上用熟石灰制取烧碱的反应原理是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,错误;C、小苏打是碳酸氢钠的俗称,与胃液中的盐酸反应生成氯化钠、水和二氧化碳,正确的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,错误;D、正常雨水偏弱酸性是因为空气中的二氧化碳与水反应生成了碳酸,反应的化学方程式为:CO2+H2O═H2CO3,正确。故选D。
2CO2+3H2O,错误;B、工业上用熟石灰制取烧碱的反应原理是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,错误;C、小苏打是碳酸氢钠的俗称,与胃液中的盐酸反应生成氯化钠、水和二氧化碳,正确的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,错误;D、正常雨水偏弱酸性是因为空气中的二氧化碳与水反应生成了碳酸,反应的化学方程式为:CO2+H2O═H2CO3,正确。故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目