题目内容
【题目】某工厂产生的废渣主要成分是 CaCO3(杂质为 Fe2O3)。用该废渣制取 CaCl2 晶 体(CaCl2xH2O)并进行组成测定,其制取的流程如下图所示:
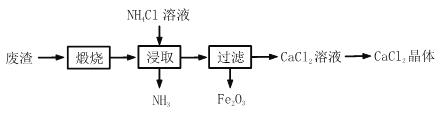
资料:NH4Cl 溶液显酸性,且浓度越高酸性越强
(1)写出煅烧时发生反应的化学方程式_____。
(2)浸取时主要发生了两个反应,分别是:CaO + H2O = Ca(OH)2 和_____。生成的NH3 能使湿润的红色石蕊试纸变_____色。
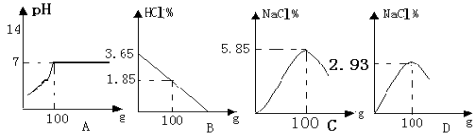
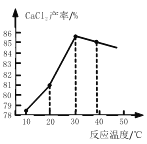
(3)在其它条件相同的情况下,CaCl2 的产率随浸取温度的变化如图所示,则宜选择的浸取温度为_____左右。
(4)若使用过量浓度较高的 NH4Cl 溶液,则所得 CaCl2 溶液中会含有 NH4Cl、_____(填化学式)等杂质。
(5)为测定晶体(CaCl2xH2O)的组成,进行如下实验:
a.称取 14.7g CaCl2xH2O 晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b.再向其中加入足量的 Na2CO3 溶液,静置。
c.过滤、洗涤、干燥、称量,得到 10.0g 固体。
①判断该步骤 b 中沉淀是否完全的方法是:静置,取少量上层清液,滴加_____溶液,若没有沉淀产生,则说明已沉淀完全。
② CaCl2xH2O 中,x=_____。
【答案】CaCO3![]() CaO+CO2↑ Ca(OH)2 +2NH4Cl=CaCl2+2NH3↑+2H2O 蓝 30℃ FeCl3 碳酸钠 2
CaO+CO2↑ Ca(OH)2 +2NH4Cl=CaCl2+2NH3↑+2H2O 蓝 30℃ FeCl3 碳酸钠 2
【解析】
(1)煅烧时发生反应的化学方程式CaCO3高温CaO+CO2↑。
(2)浸取时主要发生了两个反应,分别是:CaO + H2O = Ca(OH)2 和Ca(OH)2 +2NH4Cl=CaCl2+2NH3↑+2H2O。生成的NH3 能使湿润的红色石蕊试纸变蓝色。
(3)30℃时,CaCl2 的产率最高,则宜选择的浸取温度为30℃左右。
(4)NH4Cl溶液显酸性,且浓度越高酸性越强酸与氧化铁反应生成氯化铁,杂质是氯化铁:FeCl3;
(5)①沉淀完全说明溶液中不含有氯化钙,如果向上层清液中滴加碳酸钠,没有沉淀产生,说明已沉淀完全;
②设晶体样品中CaCl2的质量为a,则
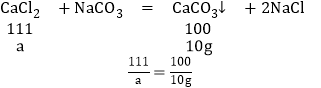
所以水的质量=14.7g-11.1g=3.6g
由CaCl2xH2O晶体中CaCl2和水的质量比可列式:![]()
x=2。

【题目】(1)某研究性学习小组为验证“氨气还原氧化铜”的实验,认真阅资料并做出以下准备。
资料准备:I.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
Ⅱ.氨气还原氧化铜的化学反应原理:2NH3+3CuO![]() 3Cu+N2+3H2O。
3Cu+N2+3H2O。
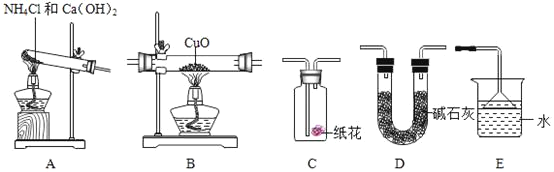
实验准备:
请回答:
①为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序_____;(填序号)
②装置A中发生反应的化学方程式_____;
③装置B观察到的现象_____,装置E的作用_____;
④将装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变蓝色,原因是_____。
(2)金属镁可与热水反应生成氢氧化镁和氢气,所得溶液呈碱性,可使酚酞溶液显紅色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
①镁与热水反应的化学方程式是_____。
②查阅资料:溶液红色褪去的原因是溶液碱性减弱。
(提出问题)导致溶液碱性减弱的原因是什么?
(假设与分析)
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的_____。
假设3:可能是氢氧化镁的溶解度随温度的降低而_____。
由碱的性质可知,假设1不成立。
(实验探究)
实验操作 | 实验现象 | 结论 |
(1)取上述红色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | _____ | 假设2成立 |
(2)取上述红色溶液,_____,_____,观察现象。 | 红色褪去 | 假设3成立 |
(拓展延伸)
③将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。
请解释其原因:_____。
④除上述金属外,根据金属活动性顺序,预测_____也能跟硫酸铜溶液反应产生上述现象(举一例即可)。