题目内容
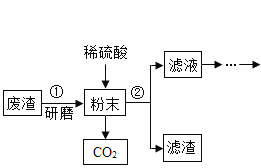
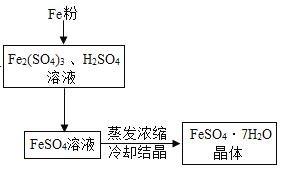
【题目】工业上利用表面含有油污且生锈的废铁屑制备硫酸亚铁晶体。
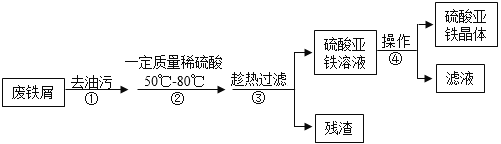
(1)下列能够去油污的试剂是__________(填字母)。
A水 B纯碱溶液 C明矾溶液 D稀硫酸
(2)步骤②中属于复分解反应的化学方程式是______________。控制“一定量稀硫酸”的目的是使铁过量,其原因是____________。
(3)步骤③要趁热过滤的原因是___________。
(4)步骤④的操作为___________、降温结晶、过滤、洗涤、干燥等。
【答案】B Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 充分将溶液中的硫酸铁转化为硫酸亚铁 防止温度降低,硫酸亚铁晶体析出和冷却过程中硫酸亚铁被氧化 蒸发浓缩
【解析】
(1)A. 油污不能溶于水,水不能除去油污,故A不符合题意;
B. 纯碱溶液显碱性,能与油污发生化学反应,除去油污。故B符合题意;
C. 明矾溶液不能溶解或乳化油污,也不与油污反应,不能除去油污。故C不符合题意;
D. 稀硫酸不能溶解或乳化油污,也不与油污反应,不能除去油污。故D不符合题意;
故选B。
(2)废铁屑在空气中放置,一定会生锈,步骤②中加入稀硫酸,硫酸与铁锈反应![]() ,属于复分解反应。控制“一定量稀硫酸”,过量的铁就会与硫酸铁反应生成硫酸亚铁,保证生成的溶质全部是硫酸亚铁,且酸性环境下硫酸亚铁的稳定性更强,不宜被氧化。故填:
,属于复分解反应。控制“一定量稀硫酸”,过量的铁就会与硫酸铁反应生成硫酸亚铁,保证生成的溶质全部是硫酸亚铁,且酸性环境下硫酸亚铁的稳定性更强,不宜被氧化。故填:![]() ;充分将溶液中的硫酸铁转化为硫酸亚铁。
;充分将溶液中的硫酸铁转化为硫酸亚铁。
(3)硫酸亚铁宜被氧化,在空气中冷却的时间越长,越容易被氧化。另外为防止温度低,硫酸亚铁晶体析出又混入杂质中。所以要趁热过滤。故填:防止温度降低,硫酸亚铁晶体析出和冷却过程中硫酸亚铁被氧化。
(4)为降温结晶时析出更多的晶体,以提高产率,在降温结晶前,应对溶液进行加热蒸发浓缩。故步骤④的操作为蒸发浓缩、降温结晶、过滤、洗涤、干燥等。故填:蒸发浓缩。