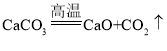题目内容
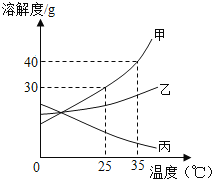
【题目】下列图象能正确反映对应变化关系的是
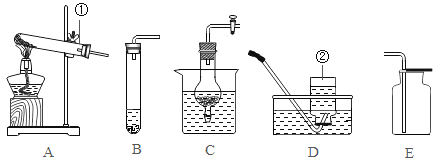
A.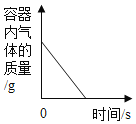 足量的碳在盛有氧气的密闭容器内充分燃烧
足量的碳在盛有氧气的密闭容器内充分燃烧
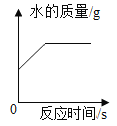
B.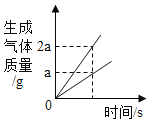 在电解器玻璃管里加满水通电
在电解器玻璃管里加满水通电
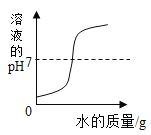
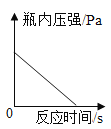
C.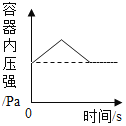 红磷在盛有一定量空气的密闭容器中燃烧至熄灭
红磷在盛有一定量空气的密闭容器中燃烧至熄灭
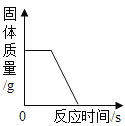
D.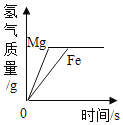 稀盐酸分成两等份,分别加入足量的Mg粉、Fe粉
稀盐酸分成两等份,分别加入足量的Mg粉、Fe粉
【答案】D
【解析】
A、固体碳和气体氧气燃烧生成二氧化碳气体,容器内气体的质量要增加,气体的最终质量不为零,不符合题意;
B、在电解器玻璃管里加满水,用惰性电极进行电解,生成的氢气和氧气的体积比为2:1,质量比是1:8,不符合题意;
C、红磷在盛有一定量空气的密闭容器中燃烧,放出了大量的热,压强增加,消耗了氧气,生成了五氧化二磷固体,冷却至室温后减小约了原来的五分之一,最终压强小于起始值,不符合题意;
D、将稀盐酸分成两等份,分别加入足量的Mg粉、Fe粉。镁的活动性大于铁,镁先反应完,氢元素全部来自于氯化氢,稀盐酸的质量相同,故最终生成氢气的质量相同,符合题意。故选D。

 字词句篇与同步作文达标系列答案
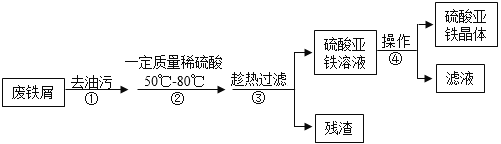
字词句篇与同步作文达标系列答案【题目】MgSO47H2O 是一种重要的化工原料,某工厂以一种镁矿石(主要成分为 SiO2和 MgCO3,还含有少量 FeCO3,其它成分忽略)为原料制备 MgSO47H2O 的主要流程如图:
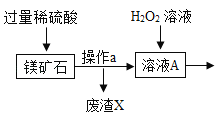
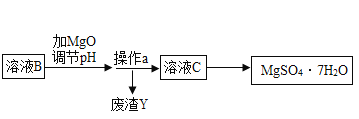
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的 pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的 pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3与稀硫酸发生反应的化学方程式为_________;为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 升高反应温度 C 用稀硫酸多次浸泡
(2)溶液 A中所含的溶质成分有_____;溶液 A中加入 H2O2溶液会生成 Fe2(SO4)3,该反应的化学方程式为_________。
(3)选用MgO调节pH使 Fe3+转化为沉淀,而不选用NaOH的原因是_____。加氧化镁调节后溶液的 pH范围是____ (用不等式表示)
(4)溶液C经加热浓缩、降温结晶、过滤、洗涤、低温干燥后得到 MgSO47H2O 晶体,低温干燥的目的是_____。
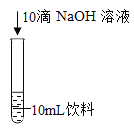
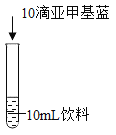
【题目】某兴趣小组在准备化学魔术时发现,若向某种红色饮料中加碱和亚甲基蓝(一种化学试剂),混合振荡后,饮料先变成蓝绿色,静置后逐渐变成黄绿色。
(提出问题)加碱和亚甲基蓝后,红色饮料的颜色为什么会发生改变?
(查阅资料)
Ⅰ.该饮料含有天然色素“花青素”,它是一种酸碱指示剂;
Ⅱ.亚甲基蓝呈蓝色,溶于水可形成蓝色溶液。
(进行实验、分析解释、获得结论)
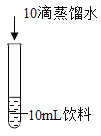
实验1初步探究饮料变色的原因。
编号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 |
实验 |
|
|
|
|
|
现象 | 呈红色 | 呈红色 | 呈黄绿色 | 呈紫色 | 振荡后呈蓝绿色,静置一段时间后呈黄绿色 |
(1)根据实验现象推测,酸碱性________影响饮料的颜色(填“会”或“不会”)。
(2)小组同学认为“加入亚甲基蓝不是饮料变蓝绿色的唯一原因”,依据的现象是_____。
(3)综合实验 1 猜想“红色饮料变蓝绿色与亚甲基蓝有关”,所依据的实验是________(填实验编号)。
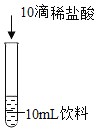
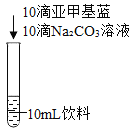
实验2进一步探究饮料颜色变化的原因。
编号 | 2-1 | 2-2 |
实验 |
|
|
现象 | 振荡后呈蓝绿色,静置一段时间后无明显变化 | 呈黄绿色 |
(4)由实验 2-1 可以推断,NaOH 在空气中变质不会导致饮料静置后变黄绿色,理由是_______。
(5)小组同学结合实验 和实验 2,推测化学魔术中红色饮料发生颜色变化的过程与_______有关。