题目内容
【题目】油炸食品、烧烤食品被营养专家称为“垃圾食品”,因为这些食品在制作过程会产生许多有害物质,如丙烯醛(化学式为C2H3CHO)。
(1)丙烯醛的摩尔质量是_________________;
(2)0.5mol丙烯醛中有__________________个氢原子;
(3)28g丙烯醛的物质的量为____________mol。
【答案】56g/mol 1.204×1024 0.5
【解析】
(1)摩尔质量是指单位物质的量的物质所具有的质量,丙烯醛的相对分子质量是56,故丙烯醛的摩尔质量是56g/mol;
(2)每个丙烯醛分子中含有4个氢原子,则0.5mol丙烯醛中含有的氢原子数=0.5 mol×4×6.02×1023 个/ mol =1.204×1024个;
(3)28g丙烯醛的物质的量为![]() 。
。

【题目】下列说法完全正确的是
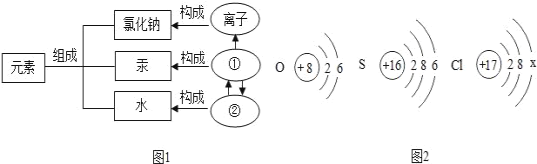
A. | 氖气的化学式 — Ne2 1个硅原子 — Si 1个钠离子 —— | B. | 决定元素种类——质子数 决定元素的化学性质——最外层电子数 决定元素周期表元素排列顺序——质子数 |
C. | 铁——由分子构成 二氧化碳——由原子构成 氯化钠——由离子构成 | D. | 分子——化学变化中的最小粒子 原子——保持物质化学性质的最小粒子 离子——带电的原子 |
A. A B. B C. C D. D
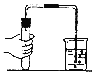
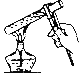
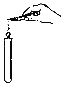
【题目】某课外小组研究“影响H2O2 生成O2快慢的因素”的课题。通过查阅资料,他们提出如下猜想。
(提出猜想)催化剂和反应物浓度都会影响H2O2 生成O2 的快慢
(实验过程)实验装置图如下:
实验操作:检查装置气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。实验记录
实验编号 | ① | ② | ③ |
反应物 | 5%H2O2 100 mL | 5%H2O2 | 3%H2O2 100 mL |
加入固体 | 0.5 g氯化钠固体 | 0.5 g二氧化锰 | |
收集气体的时间 | 165 s | 46 s | 80 s |
(1)实验②中加入H2O2的体积为_________mL。
(2)实验③中加入的固体和用量为___________。
(结论)该探究过程得出的结论是 ___________。
(反思)H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品和用量为______。
(实验拓展)小红用排水法收集的气体进行氧气的性质实验。
(1)小红进行硫磺和氧气的反应的性质实验时,在空气中与在氧气中对比燃烧,现象差别不明显。造成这种结果的原因是_________________。
(2)为探究影响过氧化氢分解速度的因素,小雨阅读课外资料得知:过氧化氢分解除了用二氧化锰,还可用氧化铜等物质作催化剂。于是在室温下做了如下实验,实验数据记录如下:
过氧化氢的质量 | 过氧化氢的浓度 | CuO的质量 | 相同时间内产生O2体积 | |
Ⅰ | 100.0g | 1% | 0.0g | 5 mL |
Ⅱ | 100.0g | 1% | 2g | 32 mL |
Ⅲ | 100.0g | 4% | 2g | 64 mL |
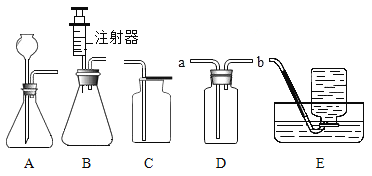
①本实验中,测量O2体积的装置是________(填编号)。
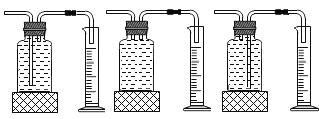
②通过对上表数据分析,I和II对比影响过氧化氢分解速率的因素是__________;III和II对比影响过氧化氢分解速率的因素是______
③写出该反应的文字表达式__________
④小雨进认为只根据加入CuO在反应中的现象还不能确定其为催化剂,还需验证__
⑤小雨利用上述原理制氧气,若达到可随时控制生成气体的速度的目的,应选择的发生装置________填序号)。